|
증기 개질기의 반응 및 열변형 특성에 미치는 공정가스와 버너가스 온도의 영향 |
|
한준희1, 김지윤2, 이정희3, 이성혁4* 1중앙대학교 기계시스템 엔지니어링학과, 2중앙대학교 차세대 에너지 연구소, 3선박해양플랜트연구소 해양플랜트 산업기술센터, 4중앙대학교 기계공학부
|
|
Effect of Process Gas and Burner Gas Temperature on Reaction and Thermal Deformation Characteristics in a Steam Reformer |
|
Jun Hee Han1, Ji Yoon Kim2, Jung Hee Lee3, Seong Hyuk Lee4* 1Dept of Mechanical Systems Engineering, Chung-Ang University 2Energy Safety Research Institute, Chung-Ang University 3Technology Center Offshore Plant Industries, KRISO 4Dept of Mechanical Engineering, Chung-Ang University |
|
요 약 본 연구는 전산유체역학 기법을 이용하여 수소 생산 플랜트의 개질 튜브 공정가스와 버너 가스 온도에 따른 화학반응과 열변형 특성을 분석한다. 개질로 내부의 온도는 약 800 K 내지 1000 K 이상으로 고온으로 유지되기 때문에 튜브의 열변형 문제가 심각하게 발생할 수 있다. 따라서 개질로의 구조건전성을 평가하고 안정된 생산력을 가진 장비를 운영하기 위해서 반응과 열변형 특성에 대한 이해는 필수적이다. 본 연구는 상용 전산해석 코드(ANSYS Fluent/Mechanical V.13.0)를 사용하여, 대류, 전도 및 복사 열전달을 포함한 복합 열전달과 난류유동을 3차원적으로 해석하였다. 특히, 열유동 특성에 따른 연성해석(Fluid-Solid Interaction: FSI)를 수행하였으며 고온 버너가스와 공정가스 운전조건에 따른 반응 특성과 열변형 변화를 분석하였다. 수치해석 결과, 개질 공정가스와 버너 가스의 주입온도가 각각 200 K 감소하면, 수소생성량은 최대 약 4 배, 최소 약 2 배 감소한다. 또한, 공정가스와 버너 가스의 주입온도에 따라 열변형은 최대 약 20%, 최소 약 15% 감소한다.
|
|
Abstract This study numerically investigates the characteristics of chemical reactions and thermal deformation in a steam reformer. These phenomena are significantly affected by the high-temperature burner gas and the process gas conditions. Because the high temperature of the burner gas ranges from 800 to 1000 K, the reformer tubes undergo substantial thermal deformation, eventually resulting in structural failure. Thus, it is necessary to understand the characteristics of the reaction and thermal deformation under the operating conditions to evaluate the reformer tubes for sustainable, stable operation. Extensive numerical simulations were carried out using commercial CFD code (ANSYS FLUENT/MECHANICA Ver. 13.0) while considering three-dimensional turbulent flows and combined heat transfer including conduction, convection, and radiation. Structural analysis considering conjugated heat transfer between solid tubes and fluid flows was conducted using the Fluid-Solid Interaction (FSI) method. The results show that when the injection temperature of the process gas and burner gas decreased, the hydrogen production rate decreased significantly, and thermal deformation decreased by at least 15 to 20%.
Keywords : Chemical reaction, Computational Fluid Dynamics, Hydrogen, Steam reforming, Structure analysis, Thermal deformation. |
1. 서론
최근 환경오염과 석탄자원의 고갈로 인해 친환경 신재생에너지를 필요로 하고 있으며 그 중 무공해 청정연료인 수소는 최근까지 수소자동차, 대중교통 그리고 연료전지 분야에서 꾸준히 연구되고 있다[1]. 수소를 생산하기 위한 방법으로는 부분 산화법, 자연 개질법 및 수증기 개질법 등이 있으며, 그 중 수증기 개질법이 가장 효율적이며 경제성이 우수한 것으로 알려져 있다[2-5].
수증기 개질 방법은 대규모 로(furnace) 내의 개질튜브내부로 유입된 수증기와 천연가스가 버너에 의해 생성되는 고온가스(800 K~1000 K)와의 열전달에 의해 튜브내부 개질반응을 일으키고 최종적으로 수소를 발생시키는 공정이다[6]. 수증기 개질법을 사용하는 석유화학 플랜트는 기동시작부터 기동정지까지 약 1년여의 주기로 가동되고 고온환경에서 운전하기 때문에 고온에 의한 튜브의 열변형 문제가 심각하게 나타난다 [7]. 그러나 현실적으로 현장에서 튜브내부의 열유동 특성과 튜브 열변형에 대한 정보를 분석하는 것은 매우 어렵기 때문에 수치해석적인 연구를 통해 반응특성과 열변형 현상을 고찰하는 것은 매우 유용하다.
현재까지 수증기 개질법에 관련된 연구는 대부분 2차원 형상에서 벽면의 온도를 사용하여 튜브 내부 온도 변화와 수소 생성량 변화에 관한 연구[7-9], 축소된 크기의 개질 튜브에서 열전달 및 화학반응 특성 또는 연료전지에서 수소 생성특성에 관한 연구는 많이 진행되어 왔다[10-12]. 하지만, 실제 석유화학 플랜트의 형상에서 열유동 및 복합열전달을 고려하고 그에 따른 화학반응과 튜브의 열변형 특성에 관해 수치해석을 진행한 연구는 거의 전무한 실정이다.
따라서 본 연구에서는 Fig. 1과 같이 수증기 개질법을 사용한 실제 석유화학 플랜트의 형상에서 산업 현장의 조건들을 고려하고, 전산유체해석을 통해 플랜트 내부 열유동 및 열전달 특성을 연구하였으며, 구조해석을 통해 튜브의 열변형 특성을 고찰하였다. 개질 공정가스와 버너 가스의 온도에 따른 화학반응 및 열변형 특성을분석하기 위해 가스의 온도를 각각 100 K와 200 K 변화시켜 총 5가지 경우로 해석경우를 설정하고 수치해석을 수행하였다.
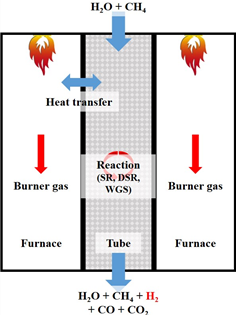
Fig. 1. Steam reforming process
2. 본론
2.1 수치해석 방법
2.1.1 유동해석
3차원 정상상태 열유동 및 열전달 해석을 위해 CFD 상용코드(ANSYS Fluent V.13.0)를 사용하였다. 수치해석을 위해 버너에서 배출되는 배가스는 공기로 가정하였고, 1700 K의 고온으로 주입되기 때문에 대류, 전도 및 복사를 포함한 복합열전달을 해석하였으며, 수증기 변성반응, 수성 가스 전화 반응, 수증기 직접 변성반응을 고려한 수증기 개질법의 흡열반응과 발열반응을 고려하였다.
개질로 내부 열유동 해석을 위해 질량, 운동량, 및 에너지 보존 방정식들을 적용하고, 난류유동의 해석을 위해 표준 k-ε 모델을 적용하였다. 개질반응을 모사하기 위해 eddy-dissipation-concept 모델을 사용하였다. 또한, 복사 열전달과 화학반응의 모사를 위해 구분종좌법(Discrete Ordinates Method)과, 종수송방정식을 이용하였으며[13], 사용된 지배방정식은 다음과 같다.
![]() , (1)
, (1)
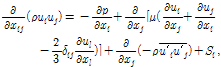 (2)
(2)
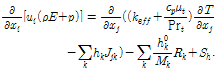 (3)
(3)
여기서, δij는 Kronecker 델타 Jjk는 k 물질에 대한 분산량, hok는 k 물질에 대한 형성엔탈피이며, Si와 Sh는 소스 항으로써 각각 다공성 영역과 복사 에너지를 나타낸다.
본 연구에서 사용한 경계조건은 Fig. 2와 Table 1에 정리되어 있다. 버너로 주입되는 가스와의 열전달로 인해 튜브 내부에 유입되는 공정가스 온도가 증가하며 다공성 촉매영역 내에서 개질반응이 발생한다. 튜브 내부 촉매는 다공성 물질로 수치 모델링하였고, 실제 운전조건을 기반으로 니크롬 35%의 평균 공극률로 설정하였다. 실제 수치해석 영역은 플랜트 전체를 모델링 후 수치해석 시간을 절약하기 위해 1/4의 영역만 사용하였으며, 두 면을 symmetry 조건으로 설정하였다. 유동해석을 위해 사용한 해석격자는 ANSYS ICEM-CFD V.13.0을 사용하여 생성하고 본 해석에서 사용된 약 590만 개의 해석격자수는 격자의존성시험을 통해 최종적으로 결정되었다. 튜브 길이는 12.3 m이며 지름은 125 mm, 두께는 10 mm으로 설정되었다.
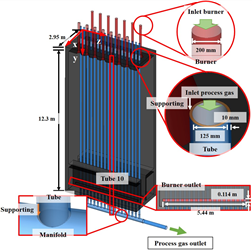
Fig. 2. A schematic of computational domain.
|
Boundary |
Conditions |
Details |
|
Inlet process gas |
Velocity inlet |
Vin = 9.346 m/s Tin = 800 K Species = H2O:CH4 |
|
Inlet burner |
Velocity inlet |
Vin = 7.85 m/s Tin = 1700 K Species = Air |
|
Outlet process gas |
Pressure outlet |
0 Pa |
|
Outlet burner |
Pressure outlet |
0 Pa |
|
Tube wall |
Coupled |
Conjugated heat transfer |
Table 2는 수증기 개질법의 대표적인 화학반응 3가지와 수치해석 시 사용한 kinetic 데이터를 나타낸다[14]. 이때 수소가 생성되는 수증기 변성반응과 수증기 직접 변성반응은 흡열반응이며, 수증기 가스 전화반응은 발열반응이다.
|
Reaction |
Reaction formula |
||
|
Enthalpy (kJ/mol) |
Er (J/kgmol) |
A |
β |
|
Steam reforming |
CH4+H2O↔CO+3H2 |
||
|
206.1 |
2.40×108 |
6.811×1035 |
-7 |
|
Water-gas shift |
CO+H2O↔CO2+H2 |
||
|
-41.15 |
6.413×107 |
2.195×102 |
0 |
|
Direct steam reforming |
CH4+2H2O↔CO2+4H2 |
||
|
165.0 |
2.439×108 |
1.145×1014 |
-4 |
2.1.2 구조해석
고온 가스에 의해 영향을 받는 튜브의 열변형 해석을 위해 본 연구에서는 상용코드 ANSYS Mechanical V.13.0을 사용하였고, 유동해석과의 연성해석을 수행하였다. 구조해석을 위한 격자로는, 사면체 격자와 육면체 격자를 혼합하여 생성하였으며, 약 260만 개의 격자를 사용하였다. 개질로 내부의 튜브는 석유화학 플랜트에서 현재 많이 사용되는 HP modified steel을 사용하였으며 열전달과 열변형에 영향을 미치는 재료물성은 Table 3.에 정리되어 있다. 실제 산업현장에서 측정된 온도 조건을 사용하여 총 5가지의 해석경우를 설정하였다. (Table 4.)
|
|
Tube |
Catalyst |
|
Material |
HP modified steel |
Nichrome |
|
k (W/m·K) |
33.2 |
21 |
|
Cp (J/kg·K) |
421.3 |
530 |
|
ρ (kg/m3) |
8050 |
8400 |
|
ε (10-6/℃) |
19.3 |
|
|
Case |
Process gas temperature (K) |
Burner gas temperature (K) |
|
1 |
800 |
1700 |
|
2 |
700 |
1700 |
|
3 |
600 |
1700 |
|
4 |
800 |
1600 |
|
5 |
800 |
1500 |
2.1.3 주입가스 온도에 따른 화학반응 특성
수소 개질을 위한 공정가스와 버너의 배출가스온도에 따른 10번 튜브 내부의 온도분포는 각각 Fig. 3 (a), (b)와 같다. 10번 튜브는 Fig. 2에서와 같이 위치하며 개질로 내부 영역에서 분석을 위해 임의로 선택된 튜브이다. 반응속도를 나타내는 Arrhenius 식에 의하면 화학반응은 온도가 더 높을수록 빠르게 발생한다. Arrhenius 식은 다음과 같다.
![]() (4)
(4)
이 식에서 ki는 i반응에 대한 반응속도 상수, R은 기체 상수이다. 계수 값인 A와 활성화 에너지 (Activation energy) Er, 온도지수 (temperature rate) β 항을 나타낸다.
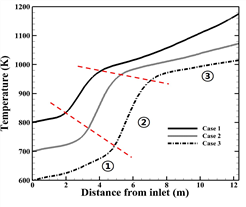
(a)
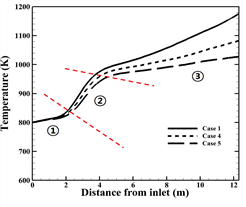
(b)
Fig. 3. Temperature distribution along the tube center(tube 10). (a) Case 1, Case 2, Case 3, (b) Case 1, Case 4, Case 5
튜브내부 공정가스의 온도는 고온의 버너가스와 복합열전달의 영향과 수증기 개질반응의 영향으로 입구에서 출구까지 온도가 상승한다. 수증기 개질반응은 활성화 에너지 이상의 온도조건에서 반응이 시작되는 흡열반응이므로, 튜브 상부(①)에서는 화학반응이 시작되지 않고, 공간상 흡열이 진행되어 활성화 에너지까지 도달하기 위해 더 많은 흡열이 진행되어 온도 상승률이 낮다. 활성화 에너지까지 튜브 내부의 온도가 상승 후 튜브 중단부(②)는 활성화 에너지에서 반응열로 전환되기 때문에 엔탈피가 감소하기 때문에 튜브 내부의 온도는 열전달의 영향만을 받게 되어 상승률이 높아진다. 또한 하단부(③)에서 반응에 일정한 엔탈피를 사용하기 때문에 다시 낮은 온도 상승률을 나타내게 된다.
Fig. 4 (a)와 (b)는 각각 반응물과 수소 생성물의 입구부터 출구까지 몰 분율 변화를 타나낸다. 본 수치해석 결과 튜브 내부의 온도가 가장 높은 Case 1의 수소 생성량이 가장 많으며, 공정가스의 온도가 200 K 낮을 때 수소 생성량이 약 4 배 감소하며, 버너가스의 온도가 200 K 낮게 주입될 때 약 2 배 감소하는 것을 알 수 있다. 식 (4) 에 따르면, 온도가 상승함에 따라 반응속도 상수가 증가하고, 반응속도 상수에 따라, 화학반응 속도가 커지며 반응양이 더 증가하기 때문이다. 본 연구에서 화학반응이 진행되는 활성화 에너지 이상의 반응열을 얻는 온도는 880 K이다. 따라서, 각 Case의 튜브 내 온도가 880 K 에 도달하는 높이인 입구에서 2.6 m, 2.8 m, 3.0 m, 4.02 m 그리고 6.2 m 지점에서 수소가 생성되는 것을 알 수 있다. 메탄과 수증기의 반응량과 수소의 생성량을 정량적으로 나타내면 Table 5.와 같다.
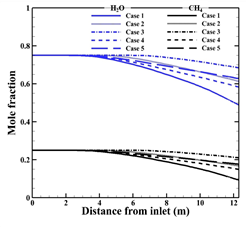
(a)
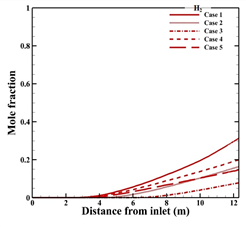
(b)
Fig. 4. Predicted mole fraction with each case
(a) Reactants, (b) Hydrogen
|
Case |
H2O |
CH4 |
H2 |
|
1 |
-62.8 |
-34.8 |
31.3 |
|
2 |
-32.8 |
-18.3 |
16.4 |
|
3 |
-15.6 |
-8.7 |
7.9 |
|
4 |
-40.0 |
-22.3 |
20.0 |
|
5 |
-29.2 |
-16.3 |
14.6 |
2.1.4 주입온도에 따른 열변형 특성
튜브의 변형을 미치는 인자들은 기계적 힘에 의한 변형과, 열에 의한 변형이 있으며, 그 중 열변형을 나타내는 식은 다음과 같다[15].
![]() . (5)
. (5)
여기서, dth는 열변형량, ε은 열팽창 계수, ΔT는 초기 설계 튜브온도와 열전달 발생 후의 온도 차이, 그리고 h는 튜브의 높이를 나타낸다. 위 식에 의하면 열변형량은 열전달에 의한 온도구배에 비례하기 때문에 국부적인 열구배가 큰 영역에서 변형량이 증가한다.
Fig. 5는 개질 공정가스와 버너가스의 주입 온도에 따른 튜브 외벽의 온도를 나타낸다. 튜브 외벽의 온도는 튜브 내부 공정가스의 온도와 마찬가지로 주입되는 공정가스와, 버너가스의 온도가 높게 주입될 때 더 많이 상승하는 것을 알 수 있다.
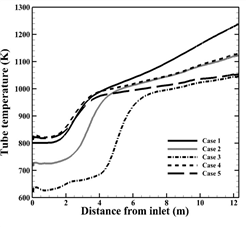
Fig. 5. Tube surface temperature distributions
개질 튜브의 열변형량은 Fig. 6과 같다. 튜브의 입구부터 출구까지 온도가 상승하기 때문에 열변형량도 입구보다 출구에서 더 많이 발생하는 것을 알 수 있다. 그리고 튜브 입구(–0.3 m), 그리고 manifold와 접촉하여 고정위치(13.5 m)에서 고정 조건을 적용하였기 때문에 열변형이 0 mm 로 나타난다.
이를 정량적으로 나타내면 Fig. 7과 같다. 모든 경우, 12.3 m에서 열변형이 가장 많이 발생한다. 이것은 로 내부에서 외부로 튜브가 노출되며 가장 많은 굽힘 현상이 발생하기 때문이다. 또한, 공정가스 온도가 100 K와 200 K만큼 감소할수록 각각 최대 10.5%, 20%의 열변형이 감소하며, 버너가스 온도가 100 K, 200 K 낮게 주입될수록 각각 최대 8.4%, 15%의 열변형이 감소한다. 출구의 온도는 Case 2와 Case 4에서 1123 K, 1030 K 으로 7 K 차이가 발생하고, Case 3과 Case 5에서 1045 K, 1054 K 으로 9 K 차이로 적은 온도차이가 발생하지만 입구에서의 온도차이가 많이 발생하기 때문에, 열변형량이 차이가 많이 발생한다.
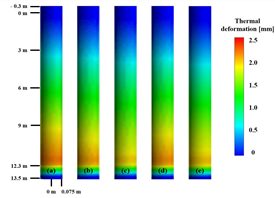
Fig. 6. Thermal deformation distribution. (a) Case 1, (b) Case 2, (c) Case 3, (d) Case 4, (e) Case 5
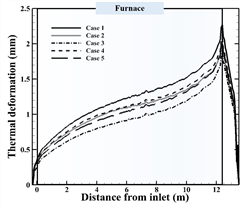
Fig. 7. Thermal deformation for the outer tube wall
3. 결론
본 연구는 석유화학 플랜트 증기 개질기의 공정가스와 버너가스의 주입 온도에 따른 화학반응 및 열변형 특성을 파악하였으며, 결론은 다음과 같다. 공정가스와 버너가스의 주입 온도는 화학반응에 영향을 미치며, 튜브 내부 온도가 감소하면 화학반응 속도가 감소한다. 공정가스와 버너가스의 온도가 각각 200 K 감소하면 수소생성량은 최대 약 4배 최소 약 2배 감소한다. 이는 흡열반응인 수증기 개질반응이 온도가 더 높을수록 더 많은 열을 흡수하여 많은 반응을 야기하기 때문이다. 또한, 공정가스와 버너가스의 주입 온도에 따라 튜브 외벽의 온도가 변화한다. 튜브 외벽의 온도에 따라 열변형이 발생하며, 공정가스와 버너가스의 온도가 각각 200 K 감소함에 따라 튜브의 열변형이 최대 20% 최소 15% 감소한다. 따라서, 공정가스와 버너가스의 주입 온도가 증가함에 따라 수소 생성량이 증가하지만, 튜브의 열변형 또한 증가하기 때문에 적절한 온도로 공정가스와 버너의 온도를 설정해야한다.
References
[1] H. S. Roh, D. K. Lee, K. Y. Koo, U. H. Jung, and W. L. Yoon, “Natural gas Steam Reforming for Hydrogen Production over Metal Monolite Catalyst with Efficient Heat-transfer”, International Journal of Hydrogen Energy, 35, pp. 1613-1619, 2010.
DOI: http://dx.doi.org/10.1016/j.ijhydene.2009.12.051
[2] A. Demirbas, Biofuels sources, “Biofuels Policy, Biofuel Economy and Global Biofuel Projections, Energy Conversion and Management. Manage, 49, pp. 2106-2116, 2008.
[3] L. Basini, K. Aasberg-Petersen, A. Guarinoni, and M. Østberg, “Catalytic Partial Oxidation of Natural Gas at Evlevated Pressure and Low Residence Time”, Catalysis Today, 64, pp. 21-30, 2001.
DOI: http://dx.doi.org/10.1016/S0920-5861(00)00504-6
[4] A. Qi, S. Wang, C. Ni, and D. Wu, “Autothermal Reforming of Gasoline on Rh-based Monolithic Catalysts”, International Journal of Hydrogen Energy, 32, pp. 981-991, 2007.
DOI: http://dx.doi.org/10.1016/j.ijhydene.2006.06.072
[5] H. Arbag, S. Yasyerli, N. Yasyerli, and C. Dogu, “Activity and Stability Enhancement of Ni-MCM-41 Catalysts by Rh Incorporation for Hydrogen from Dry Reforming of Methane”, International journal of Hydrogen Energy, 35, pp. 2296-2304, 2010.
DOI: http://dx.doi.org/10.1016/j.ijhydene.2009.12.109
[6] J. A. Liu, “Kinetics, Catalysis and Mechanism of Methane Steam Reforming”, WPI Chemical Engineering Department, 2006.
[7] M .H. Shariat, A. h. Faraji, A. Ashafriahy, M. M. Alipour, “In Advanced Creep Failure of H.P. Modified Reformer Tubes in an Ammonia Plant”, The Journal of Corrosion Science and Engineering, 6, pp. 1-20, 2003.
[8] L. Lao et al, “CFD Modeling and Control of a Steam Methane Reforming Reactor”, Chemical Engineering Science, 148, pp. 78-92, 2016.
DOI: http://dx.doi.org/10.1016/j.ces.2016.03.038
[9] M. Nikodemus, “Identifying Favorable Catalyst Design Features in Methane Steam Reforming Using Computational Fluid Dynamics”, WORCESTER POLYTECHNIC INSTITUTE, 2013.
[10] G. Dixon, M. Nijemeisland, “CFD as a Design Tool for Fixed-Bed Reactors”, Industrial & Engineering Chemistry Research, 40, pp. 5246-5254, 2001.
DOI: http://dx.doi.org/10.1021/ie001035a
[11] M. N. Pedernera, J. Pina, D. O. Borio, and V. Bucala, “Use of a Heterogeneous Two-dimensional Model to Improve the Primary Steam Reformer Performance”, Chemical Engineering Journal, 94, pp. 29-40, 2003.
DOI: http://dx.doi.org/10.1016/S1385-8947(03)00004-4
[12] M. Ni, “2D Heat and Mass Transfer Modeling of Methane Steam Reforming for Hydrogen Production in a Compact Reformer”, Energy Conversion and Management, 65, pp. 155-163, 2013.
DOI: http://dx.doi.org/10.1016/j.enconman.2012.07.017
[13] J. Lee, J. H. Han et al, “Characteristics of Heat Transfer and Chemical Reaction of Methane-Steam Reforming in a Porous Catalytic Medium”, Journal of Mechanical Science and Technology, 30, pp. 473-481, 2016.
DOI: http://dx.doi.org/10.1007/s12206-015-1252-1
[14] C. G. Choi, T. Y. Chung, J. H. Nam and D. H. Shin, “A Comparative Study for Steam-Methane Reforming Reaction Analysis Model.”, Transactional of the Korean Society of Mechanical Engineers B, 32, pp. 497-503, 2008.
DOI: http://dx.doi.org/10.3795/KSME-B.2008.32.7.497
[15] ANSYS Mechanical, “ANSYS Mechanical APDL Theory Reference; Version 13.0.”, ANSYS Inc, Canonsburg, 2013.
|
한 준 희(Jun Hee Han) [정회원] |
|
|
|
•2015년 2월 : 영남대학교 화학공학과 학사졸업 •2015년 3월 ~ 현재 : 중앙대학교 기계시스템 엔지니어링학과 석사과정
|
|
<관심분야> 전산유체역학, 열유체 |
|
|
김 지 윤(Ji Yoon Kim) [정회원] |
|
|
|
• 1980년 2월 : 국민대학교 금속공학과 공학사 • 1984년 2월 : 연세대학교 산업대학원 금속공학과 공학석사 • 1996년 2월 : 국민대학교 금속공학과 공학박사 • 2005년 7월 ~ 2008년 7월 : 한국가스안전공사 연구원장 |
|
• 2008년 7월 ~ 현재 : 중앙대학교 기계공학부 연구교수
<관심분야> 에너지, 안전, 금속공학 |
|
|
이 정 희(Jung Hee Lee) [정회원] |
|
|
|
•1992년 2월 : 중앙대학교 기계공학과 공학사 •1994년 2월 : 중앙대학교 기계공학과 공학석사 •1999년 2월 : 중앙대학교 기게공학콰 공학박사 •2009년 9월 ~ 2016년 1월 : 서강대 다중현상 CFD 연구센터 연구교수 |
|
•2016년 2월 ~ 현재 : 선박해양플랜트연구소 해양플랜트 산업기술션터 책임연구원
<관심분야> 전산열유체, 연성해석, 다상유동 |
|
|
이 성 혁(Seong Hyuk Lee) [정회원] |
|
|
|
•1995년 2월 : 중앙대학교 기계공학과 공학석사 •1999년 2월 : 중앙대학교 기계 공학과 공학박사 •2001년 3월 ~ 2003년 2월 : 서울대학교 박사 후 과정 •2013년 5월 ~ 현재 : 중앙대학교 기계공학과 교수 |
|
<관심분야> 전산유체역학, 열전달 및 열공학 |
|



