|
이중 고온용융 압출 성형된 이중 방출능을 가지는 제형의 개발 |
|
김동욱1, 강진양2, 강창민2, 박준범2* 1청주대학교 제약공학과, 2삼육대학교 약학대학
|
|
Development of Pharmaceutical Dosage Forms with Biphasic Drug Release using Double-Melt Extrusion Technology |
|
Dong-Wook Kim1, Chin-Yang Kang2, Changmin Kang2, Jun-Bom Park2* 1Department of Pharmaceutical Engineering, Cheongju University 2College of Pharmacy, Sahmyook University |
|
요 약 본 이 연구의 목적은 이중 고온용융 압출법을 이용하여 기존의 방법으로 가지기 어려운 이상성의 약물방출 양상을 가지는 제형을 개발하는 것이다. 이 고온용융 압출물은 동회전 능을 가지는 두 개의 스크류가 장착된 압출기를 이용하여 제조되었다. Hydroxpropylmethylcellulose(HPMC) 같은 상대적으로 유리전이 온도가 높은 고분자를 이용하여 1차로 고온용융 압출물이 제조되었고, 이 1차 압출물과 상대적으로 유리전이 온도가 낮은 HPMC-AS(Acceate succinate)나 PEO(polyethlene oxide)를 이용하여 2차로 고온용융 압출물이 제조되었다. 또한 이중 고온용융 압출물과의 비교시험을 위해 같은 조성과 같은 조건하에서 일반적인 한 번의 고온용융 압출물도 제조되었다. 시차주사 열량계를 통해 물리적인 성질이 평가되었고, 미국약전의 제 1법에 따라 37 ± 0.5°C와 100 rpm의 조건에서 약물방출 시험이 진행되었으며 그 약물방출은 유사성인자(f2)를 이용하여 평가되었다. 시차주사 열량계 결과는 이부프로펜의 결정성이 이중 고온용융 압출법에서나 한번 고온용융 압출법 모두에서 무정형으로 변화된 것을 확인할 수 있었으며, 용출시험에서는 이중 고온용융 압출법에서 더욱 더 이상적인 이부프로펜의 방출을 인공위액(pH 1.2)에서 2시간, 0차 방출을 인공장액(pH 6.8)에서 6시간 동안 확인할 수 있었다. 빠른방출이 요구되는 글리메피라이드의 경우는 이중 고온용융 압출물에서는 60분에 80% 이상의 빠른 약물 방출을 보인 반면, 한번 고온용융 압출물에서는 약물방출이 HPMC와의 상호작용 때문에 느려져서 기준을 만족하지 못했다. 유사성 인자(f2) 값도 28.5로 매우 다른 방출을 보여주고 있음이 통계적으로 확인되었다. 이상의 결과들을 종합해 볼 때, 이중 고온용융 압출법은 완건성이 좋은 또 원하는 약물방출을 얻을 수 있는 방법이라 할 수 있다. |
|
Abstract The aim of this study was to develop pharmaceutical dosage forms with a bi-phasic drug using a double extrusion approach. Hot melt extrusion was performed using a co-rotating twin-screw extruder. The. 1st melt extrusion was performed using polymer with a relatively higher Tg, such as HPMC and the 2nd melt extrudate was obtained using the 1st extrudate and polymers with a lower Tg, such as HPMC-AS and PEO. In addition, the formulation with all the content in the same proportion as the double extudate was produced using single extrusion for comparison. Physical characterization was performed on the formulations employing differential scanning calorimetry (DSC). In vitro release tests were studied using a USP Type-I apparatus at 37 ± 0.5°C and 100 rpm. The similarity factor (f2) was also used to check the difference statistically. The DSC results indicated that the crystallinity of ibuprofen was changed to an amorphous state after extrusion in both double and single melt extrusion. Double melt extrudate with ibuprofen showed the desired release in acidic media (pH 1.2) in the first two hours and basic (pH 6.8) during six hours. Double melt extrudate with glimepiride showed faster release in 60 min of over 80%, whereas the single extrudate with glimepiride showed retarded release due to the interaction with HPMC. The similarity factor(f2) value was 28.5, which demonstrates that there were different drug release behavior between the double and single extrusion. Consequently, the double melt extrudated formulation was robust and gave the desired drug release pattern.
Keyword : Biphasic drug release, Double melt extrusion, Hot melt extrusion, Bi-layer |
1. 서론
고온용융 압출법(Hot-melt extrusion)은 플라스틱, 고무재질, 식품 제조 산업 등에 오래 전부터 사용되어 오던 기술이며, 최근 고온용융 압출법을 과립, 펠렛, 정제, 좌제, 임플란트, 스텐트 및 경피 흡수제 등 다양한 형태의 의약품의 제조에 응용하기 시작하면서, 의약품의 적용 가능성 또한 넓어졌다[1-5].
고온용융 압출법을 통해 약제학적 조성물을 생산하는 과정은, 1) 압출 공정 중 용융된 고분자가 열적 바인더와 약물의 저장고 역할을 하게 될 뿐만 아니라 약물의 냉각 및 응결 시 약물 방출의 지연제로써의 역할을 할 수 있고[6]; 2) 공정상 기존의 제약기술에서 사용되었던 유기 용매나 물이 필요하지 않으므로 많은 시간이 소요되는 건조과정 등의 여러 가지 공정단계를 간소화 할 수 있어, 제조 시간이 짧으며[7]; 3) 용융된 고분자 매트릭스 상에서의 약물들은 압출기의 스크루를 통해 교반 및 혼합되어 약물의 일정한 분산을 이룰 수 있을 뿐만 아니라 연속공정으로 효율성 또한 높일 수 있고[2]; 4) 특정한 고분자 또는 계면 활성제를 이용하여 가용화 범위가 넓고 생체이용률을 조절할 수 있다[8];는 장점을 가져, 약제 생산 공정에서 의약품 제조 기술로서 유용하게 이용되고 있다. 고온용융 압출법을 이용하여 약제학적 조성물을 생산하는 과정에서 다양한 조건의 변경을 통해, 약물의 제어 방출(controlled release, modified-release)[9], 타겟팅 방출(targeting release)[10], 서방성 방출(sustained-release)[11] 및 쓴 맛 차폐(bitter taste masking)[4]와 같은 조절이 가능할 수 있음이 연구되고 있다. 고온용융 압출의 대표적인 모식도를 Fig. 1에 나타내었다.
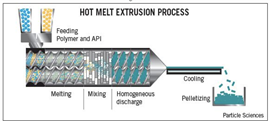
Fig. 1. The Structure of Hot Melt Extrusion
그러나, 이러한 고온용융 압출을 통한 정제 또는 캡슐 등의 약제학적 제형을 생산하기 위해서는 최종적으로 밀링(milling) 과정이 필수적으로 요구되며, 밀링 과정 중에 고분자 및 캐리어에 캡슐화되어 있던 약물이 다시 제형의 표면에 나타나 원래의 고온용융 압출물이 가지는 약물조절 기능이 반감되는 현상이 종종 발행한다[12]. 또, 일반적인 이 기술로는 약물의 이중방출(Bi-phasic)과 서로 다른 약물의 방출형태를 가지는 두 가지 약물을 동시에 탑재하기는 사실상 불가능하다[10].
따라서, 본 연구의 목적은 기존의 고온용융 압출을 이용하여 밀링 과정 중에 발생하는 약물의 방출능을 저해하는 현상을 최소화 하고, 약물의 이중방출을 가능하게 하며, 서로 다른 약물의 방출형태를 가져야 하는 두 가지 약물을 하나의 고온용융 압출물에 탑재하는 것이다. 이 연구는 전 세계적으로 처음으로 시도되는 연구이다.
2. 실험방법
2.1 시약 및 기기
시약은 metformin HCl(Hwail,Korea), hydroxypropy- lmethylcellulose(HPMC, Shin-Etsu, Japan), hydroxy- propylmethylcellulose-acetate succinate (HPMC-AS, Shin-Etsu, Japan), lactose monohydrate(NZ, newzealand), Polyethylene Oxide (PEO, BASF, Germany), magnesium stearate(Petwr greven, Germany)과 용매로서 Methanol (HPLC grade, Daejung, Korea), Acetonitrile(HPLC grade, Daejung, Korea), water(3차 증류수)를 사용하였고 고온용융 압출기로는 Pharma 11mm (Thermo Fisher Scientific, Waltham, USA)를 사용하고 분석기기로는 dissolution teser(Hanson SR8PLUS, USA), HPLC (Agilent 1200, USA) 등을 사용하였다.
2.2 일반적인 고온용융 압출물의 제조
2.2.1 이부프로펜 고온용융 압출물
주 약물인 이부프로펜(20% w/w)을 HPMC-AS와 HPMC 와 1:1로 혼합되어 있는 혼합물 (80% w/w)과 V-shell blender (GlobePharma, MaxiBlend, New Brunswick, NJ, USA)를 이용하여 혼합했다. 그 혼합물을 co-rotating하는 twin-screw를 가지고 있는 hot melt extruder(11 mm Process 11, ThermoFisher Scientific, Pittsburgh, PA, USA)를 이용하여 screw 속도는 100 rpm으로 고정하고 150∼170℃의 작동온도에서 고온용융 압출물을 제조하였다[3,4].
2.2.2 메트포르민과 글리메피라이드의 복합 고온용융 압출물 제조
주 약물인 메트포르민과 글리메피라이드를 먼저 일정 비율로 혼합한 후(20% w/w), HPMC와 PEO가 1:1로 혼합되어 있는 혼합물 (80% w/w)을 위의 2.2.1의 이부프로펜 고온용융 압출과 같은 방법으로 고온용융 압출물을 제조하였다[3,6,8].
2.3 이중 고온용융 압출물의 제조
2.3.1 이부프로펜 이중 고온용융 압출물
주 약물인 이부프로펜 (20% w/w)과 HPMC-AS(80% w/w)를 V-shell blender (GlobePharma, MaxiBlend, New Brunswick, NJ, USA)를 이용하여 잘 혼합한 후, co-rotating하는 twin-screw를 가지고 있는 hot melt extruder (11 mm Process 11, ThermoFisher Scientific, Pittsburgh, PA, USA)를 이용하여 screw 속도는 100 rpm으로 고정하고 150∼170℃의 작동온도에서 1차 고온용융 압출물을 제조하였다. 그 후 이부프로펜 (20% w/w)과 HPMC (80% w/w) 혼합물과 1차에서 얻어진 고온용융 압출물을 1:1의 비율로 screw 속도는 50 rpm으로 고정하고 110∼140℃의 작동온도에서 2차 고온용융 압출물을 제조하였다.
2.3.2 메트포르민과 글리메피라이드의 복합 이중 고온용융 압출물의 제조
주 약물인 메트포르민 (20% w/w)과 HPMC(80% w/w)를 V-shell blender (GlobePharma, MaxiBlend, New Brunswick, NJ, USA)를 이용하여 잘 혼합한 후, co-rotating하는 twin-screw를 가지고 있는 hot melt extruder (11 mm Process 11, ThermoFisher Scientific, Pittsburgh, PA, USA)를 이용하여 screw 속도는 100 rpm으로 고정하고 130∼150℃의 작동온도에서 1차 고온용융 압출물을 제조하였다. 또 다른 주 약물인 글리메피라이드 (20% w/w)와 PEO (80% w/w)의 혼합물과 1차에서 얻어진 고온용융 압출물을 1:1의 비율로 screw 속도는 50 rpm으로 고정하고 60∼80℃의 작동온도에서 2차 고온용융 압출물을 제조하였다.
2.4 시차주사 열량계(Differencial Scanning Calorimnetry)
주 약물의 결정성의 변화를 파악하고자 이부프로펜과 이부프로펜을 탑재한 고온용융 압출물을 시차주사 열량계(Perkin-Elmer, Waltham, USA)를 통해 평가하였다. 25∼150℃에서 열변화에 의한 주 약물의 고온용융 압출물의 변화를 확인하였으며, 온도는 5 ℃/min 으로 변화시켰다.
2.5 약물 방출 확인
인공 위액 (pH 1.2) 완충액 900 ml을 사용하여 37±5℃에서 대한약전 용출시험 제 2법, 패들법으로 회전수 50 rpm에서 용출을 2시간 동안 진행하였고, 그 후 인공 장액 (pH 6.8)에서 6시간 동안 약물 방출을 관찰하였다. 5 ml의 용출액을 채취하고 동량의 용출액으로 보충하였으며 채취한 용출액은 0.45 um 시린지 필터를 이용하여 여과한 후 바이알에 담아 검액을 제조하였다. 이를 통해 시간별 약물 방출량을 정제의 함량에 대비하여 계산하여 시간에 따른 약물방출비율로 계산하여 그래프로 나타내었다.
2.6 HPLC의 분석
표준액으로 각 표준품 30 mg을 정밀하게 달아 아세토니트릴 100 ml을 가하여 이 액 5 ml을 정확하게 취해 이동상으로 10배 희석하여 표준액으로 한다. 검출기는 자외부흡광광도계로써 232 nm 파장에서 측정하며 C18 컬럼(5 µm, 250×4.6 mm)를 사용하였다. 칼럼온도는 40℃로 하고 유속은 1.0 ml/min이었다.
2.7 유사인자(f2)에 의한 평가
![]() -(1) [16]
-(1) [16]
위의 식 (1) 에서, n은 용출률 (%)을 측정하는 시점의 수이며, Rj 와 Tj는 각각 시점 j에서 대조샘플과 시험샘플의 평균 용출률 (%)이다. 각 시간대의 용출률을 이용하여 용출유사 정도인 유사인자(f2)를 계산하였으며, 그 값이 50에서 100사이의 수치를 지니면 두 용출 곡선은 유사한 것으로 간주한다. 따라서 이 f2 값이 클수록 두 용출 곡선의 유사성이 증가된다고 할 수 있다[16].
3. 결과 및 고찰
3.1 이중 고온용융 압출
상대적으로 높은 녹는점 또는 유리전이 온도를 가진 고분자를 중합체로 사용하여 높은 온도에서 1차 고온용융 압출을 수행한 다음, 상대적으로 낮은 녹는점 또는 유리전이 온도를 가진 고분자를 중합체로 사용하여 2차 고온용융 압출을 수행하여 이중-층의 고온용융 압출물을 수득할 수 있는 방법을 개발하고자 하였다. 이중 고온용융 압출(Double-melt extrusion)방법으로 제조되는 압출물의 도식을 아래 Fig. 2에 나타내었다.
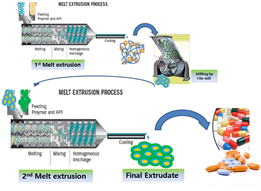
Fig. 2. Scheme of Double-Melt Extrusion Formulation
3.2 시차주사 열량계(Differencial Scanning Calorimnetry)
시차주사 열량계의 결과를 그림 Fig. 3에 나타내었다. 이부프로펜은 75~77℃의 녹는점[13]을 갖고 있다고 알려져 있는데, 시차주사열량계 결과 또한 76 ℃ 부근에서 endothermic한 peak를 보이고 있다. 그러나, single melt extrusion 이나 double melt extrusion의 경우 이부프로펜을 각각 20% 정도나 탑재하고 있음에도 불구하고 이부프로펜의 endothermic한 peak가 사라졌다. 이것은 결정성을 가지고 있던 이부프로펜이 고온용융 압출 후, 무정형의 상태가 되었음을 의미한다. 일반적으로 무정형 상태의 주 약물은 용해도가 증가되어 생체이용률이 증가된다[6]. 또한 일반적인 고온용융 압출물과 이중 고온용융 압출물 사이에 물리화학적으로 큰 차이가 없음을 보여준다고 할 수 있다.
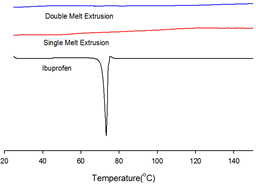
Fig. 3. The result of DSC thermograms.
3.2 이부프로펜 고온용융 압출
하나의 약물을 고온용융 압출물로 제형화할 때, 단일-층 또는 이중-층으로 제조하는 것에 따라 약물 방출 양상에서 차이가 있는 것을 확인할 수 있었다.
2.2.1 에서 제조한 하나의 약물(이부프로펜)을 포함하는 단일-층 고온용융 압출물 및 2.2.2 에서 제조한 하나의 약물(이부프로펜)을 포함하는 이중-층 고온용융 압출물을 각각 대상으로 하여, 주변 pH 및 시간의 흐름에 따라 약물이 방출되는 정도를 확인하였다. 약제를 섭취하였을 때의 환경을 가정하기 위해, 초기 2 시간 동안 위내 환경을 대변하는 pH 1.2의 수용액에서 반응한 다음 장내 환경인 pH 6.8의 수용액으로 각각의 고온용융 압출물을 옮겨 약물이 용출되도록 유도하였다. 반응 개시 후, 시간 별로 수용액을 수득하고 수용액 내 이부프로펜의 농도를 확인하였다.
그 결과, Fig. 4에 나타난 바와 같이, 단일-층의 고온용융 압출물은 장내 방출용 중합체(enteric polymer)인 HPMC-AS로 인해 영향을 받아[14,15], 초기 약물 방출 정도가 이중-층의 고온용융 압출물에 비해 다소 낮은 속도를 나타내는 것을 확인하였다. 이에 반해, 이중-층의 고온용융 압출물은 산성 환경에서, 또는 이로부터 중성 환경으로 주변 환경이 변화한 이후에도 이부프로펜의 방출 정도가 지속적으로 나타나, 약물 방출의 가장 이상적인 0차 방출이 계속되는 것을 확인하였다[16]. 또한 통계적 비교 방법인 유사성 인자(f2)를 이용해 두 용출 곡선 비교시 46.2로 같지 않은 약물방출 양상을 보여주고 있음을 확인할 수 있었다[16].
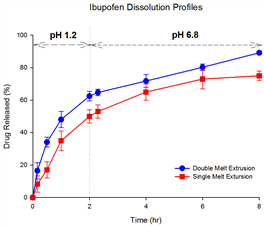
Fig. 4. Dissolution profiles in ibuprofen loaded-single melt extrusion and double melt extrusion(n=6).
3.3 메트포르민과 글리메피라이드의 복합 고온용융 압출
두 종류의 서로 다른 약물을 고온용융 압출물로 제형화할 때, 단일-층 또는 이중-층으로 제조하는 것에 따라 약물 방출 양상에서 차이가 있는 것을 확인할 수 있었다. 2.3.1에서 제조한 메트포르민 및 글리메피리드 혼합 약물을 단일-층 고온용융 압출물 및 2.3.2에서 제조한 혼합된 약물을 포함하는 이중-층 고온용융 압출물을 각각 대상으로 하여, 주변 pH 및 시간의 흐름에 따라 약물이 방출되는 정도를 확인하였다.
메트포르민의 경우 단일-층으로 제조한 경우와 이중-층으로 제조한 경우, 제조의 방법의 차이에 따른 영향이 전혀 없이 3시간 동안 일정하게 약물을 지속적으로 방출하였다.
그러나, 글리메피라이드의 경우 제조방법에 따른 차이를 현저히 보여 주었다. 글리메피라이드는 제 2형 당뇨에 흔히 사용되는 약물로 반감기가 상대적으로 길어서[17] 1일 1회로 대부분의 환자가 복용하는 약물로 약물의 빠른 방출이 중요하다[18]. 따라서 글리메피라이드는 60분이내에 인공 위액(pH 1.2)에서 최소 75% 이상의 약물을 방출해야 한다. 그러나, Fig. 5에 나타난 바와 같이 단일-층의 고온용융 압출물의 경우 HPMC와의 상호 작용에 의해 글리메피리드도 약물의 방출이 느리게 나타나고, 60분 동안 60%정도의 약물방출만을 보인 반면, 이중-층의 고온용융 압출물에서는 글리메피리드의 방출이 빠른 속도로 나타났으며, 60분동안 80% 이상의 약물방출 양상을 보여주었다. 또한 통계적 비교 방법인 유사성 인자(f2)를 이용해 두 용출 곡선 비교시 28.5로 매우 서로 다른 약물방출 양상을 보여주고 있음이 확인 되었다[16].
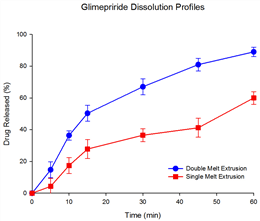
Fig. 5. Dissolution profiles in glimepiride loaded-single melt extrusion and double melt extrusion(n=6).
4. 산업상의 이용성 및 결론
본 연구는 상대적으로 높은 녹는점 또는 유리전이 온도를 가진 고분자를 중합체로 사용하여 높은 온도에서 1차 고온용융 압출을 수행한 다음, 밀링 후 상대적으로 낮은 녹는점 또는 유리전이 온도를 가진 고분자를 중합체로 사용하여 이중-층의 고온용융 압출물 제조할 수 있었다.
본 연구를 통해 제조된 이중-층의 고온용융 압출물인 약제학적 조성물은, 종래 고온용융 압출 방법에 의해 제조되는 약제학적 조성물에 비해 이중층으로 제조되므로 쓴 맛을 차폐(taste masking)하는 기술에 널리 활용될 수 있다. 또한, 속방 및 서방 등의 방출 양상이 서로 다른 약물을 동시에 함유하는 약제를 제조할 수 있고, 배합금기(incompatible)한 두 가지의 약물을 이중-층 시스템을 이용하여 내층과 외층에 탑재한 형태의 약제를 제조할 수 있다. 이 외에도, 급속한 약물 방출을 억제하는 탬퍼링 방지(tamper resistance) 효과를 나타낼 수 있어, 종래 기술에 의해 제조되는 고온용융 압출 기술보다 효과적인 형태의 약제를 제조할 수 있으므로, 의약 산업의 약제 제조 공정에서 유용하게 사용될 수 있다[19].
References
[1] M. M. Crowley, F. Zhang, M. A. Repka, S. Thumma, S. B. Upadhye, S. Kumar Battu, J. W. McGinity, C. Martin, “Pharmaceutical applications of hot-melt extrusion: part I”, Drug development and industrial pharmacy, vol. 33, pp. 909-926, 2007.
DOI: http://dx.doi.org/10.1080/03639040701498759
[2] J.-B. Park, C.-Y. Kang, W.-S. Kang, H.-G. Choi, H.-K. Han, B.-J. Lee, “New investigation of distribution imaging and content uniformity of very low dose drugs using hot-melt extrusion method”, International journal of pharmaceutics, vol. 458, pp. 245-253, 2013.
DOI: http://dx.doi.org/10.1016/j.ijpharm.2013.10.027
[3] J.-B. Park, S. Prodduturi, J. Morott, V. I. Kulkarni, M. R. Jacob, S. I. Khan, S. P. Stodghill, M. A. Repka, “Development of an antifungal denture adhesive film for oral candidiasis utilizing hot melt extrusion technology”, Expert opinion ondrug delivery, vol. 12, pp. 1-13, 2015.
[4] M. B. Pimparade, J. T. Morott, J.-B. Park, V. I. Kulkarni, S. Majumdar, S. Murthy, Z. Lian, E. Pinto, V. Bi, T. Durig, “Development of taste masked caffeine citrate formulations utilizing hot melt extrusion technology and in vitro–in vivo evaluations”, International journal of pharmaceutics, vol. 487, pp. 167-176, 2015.
DOI: http://dx.doi.org/10.1016/j.ijpharm.2015.04.030
[5] P. H.-L. Tran, T. T.-D. Tran, J. B. Park, B.-J. Lee, “Controlled release systems containing solid dispersions: strategies and mechanisms”, Pharmaceutical research, vol. 28, pp. 2353-2378, 2011.
DOI: http://dx.doi.org/10.1007/s11095-011-0449-y
[6] M. A. Repka, S. K. Battu, S. B. Upadhye, S. Thumma, M. M. Crowley, F. Zhang, C. Martin, J. W. McGinity, “Pharmaceutical applications of hot-melt extrusion: Part II”, Drugdevelopment and industrial pharmacy, vol. 33, pp. 1043-1057, 2007.
DOI: http://dx.doi.org/10.1080/03639040701525627
[7] M. Maniruzzaman, M. Rana, J. Boateng, J. Mitchell, D. Douroumis, “Dissolution enhancement of poorly water-soluble APIs processed by hot-melt extrusion using hydrophilic polymers”, Drug development and industrial pharmacy, vol. 39, pp. 218-227, 2013.
DOI: http://dx.doi.org/10.3109/03639045.2012.670642
[8] W. Wang, Q. Kang, N. Liu, Q. Zhang, Y. Zhang, H. Li, B. Zhao, Y. Chen, Y. Lan, Q. Ma, “Enhanced dissolution rate and oral bioavailability of Ginkgo biloba extractby preparing solid dispersion via hot-melt extrusion”, Fitoterapia, vol. 102, pp. 189-197, 2015.
DOI: http://dx.doi.org/10.1016/j.fitote.2014.10.004
[9] A. Q. Vo, X. Feng, J. T. Morott, M. B. Pimparade, R. V. Tiwari, F. Zhang, M. A. Repka, “A novel floating controlled release drug delivery system prepared by hot-melt extrusion”, European Journal of Pharmaceutics and Biopharmaceutics, vol. 98, pp. 108-121, 2016.
DOI: http://dx.doi.org/10.1016/j.ejpb.2015.11.015
[10] R. V. Tiwari, H. Patil, M. A. Repka, “Contribution of hot-melt extrusion technology to advance drug delivery in the 21st century”, Expert opinion on drug delivery, vol. 13, pp. 451-464, 2016.
DOI: http://dx.doi.org/10.1517/17425247.2016.1126246
[11] B. Claeys, A. Vervaeck, X. K. Hillewaere, S. Possemiers, L. Hansen, T. De Beer, J. P. Remon, C. Vervaet, “Thermoplastic poly-urethanes for the manufacturing of highly dosed oral sustained release matrices via hot melt extrusion and injection molding”, European Journal of Pharmaceutics and Biopharma- ceutics, vol. 90, pp. 44-52, 2015.
DOI: http://dx.doi.org/10.1016/j.ejpb.2014.11.003
[12] M. Maniruzzaman, J. S. Boateng, M. Bonnefille, A. Aranyos, J. C. Mitchell, D. Douroumis, “Taste masking of paracetamol by hot-melt extrusion: an in vitro and in vivo evaluation”, European Journal of Pharmaceutics and Biopharmaceutics, vol. 80, pp. 433-442, 2012.
DOI: http://dx.doi.org/10.1016/j.ejpb.2011.10.019
[13] B. Sütő, S. Weber, A. Zimmer, G. Farkas, A. Kelemen, M. Budai-Szűcs, S. Berkó, P. Szabó-Révész, E. Csányi, “Optimization and design of an ibuprofen-loaded nanostructured lipid carrier with a 23 full factorial design”, Chemical Engineering Research and Design, vol. 104, pp. 488-496, 2015.
DOI: http://dx.doi.org/10.1016/j.cherd.2015.09.010
[14] A. L. Sarode, S. Obara, F. K. Tanno, H. Sandhu, R. Iyer, N. Shah, “Stability assessment of hypromellose acetate succinate (HPMC-AS) NF for application in hot melt extrusion (HME)”, Carbohydrate polymers, vol. 101, pp. 146-153, 2014.
DOI: http://dx.doi.org/10.1016/j.carbpol.2013.09.017
[15] D.-W. Kim, “Evaluation of Sustained-release Dosage Form with Novel Metformin Salts”, Journal of the Korea Academia-Industrial cooperation Society, vol. 16, pp. 7838-7843, 2015.
[16] J.-B. Park, “Development of Gastric Retentive Bi-layered Tablet using Floating Drug Delivery System”, Journal of the Korea Academia-Industrial cooperation Society, vol. 16, pp. 7549-7554, 2015.
DOI: http://dx.doi.org/10.5762/KAIS.2015.16.11.7549
[17] J. Urbanova, M. Andel, J. Potockova, J. Klima, J. Macek, P. Ptacek, T. Kumstyrova, P. Heneberg, “Half-Life of Sulfonylureas in HNF1A and HNF4A Human MODY Patientsis not Prolonged as Suggested by the Mouse Hnf1a/Model”, Current pharmaceutical design, vol. 21, pp. 5736-5748, 2015.
DOI: http://dx.doi.org/10.2174/1381612821666151008124036
[18] J.-Y. Kim, D.-W. Kim, Y.-M. Kuk, C.-W. Park, Y.-S. Rhee, T.-O. Oh, K.-Y. Weon, E.-S. Park, “Investigation of an active film coating to prepare new fixed-dose combination tablets for treatment of diabetes”, International journal of pharmaceutics, vol. 427, pp. 201-208, 2012.
DOI: http://dx.doi.org/10.1016/j.ijpharm.2012.01.057
[19] Y. H. Lee, K. Y. Weon, “Improving the stability of gel mass of vegetable soft capsule”, Journal of the Korea Academia-Industrial cooperation Society, vol. 17, pp. 397-404, 2016.
DOI: http://dx.doi.org/10.5762/KAIS.2016.17.5.397
|
김 동 욱(Dong-Wook Kim) [정회원] |
|
|
|
•1997년 2월 : 경희대학교 약학과 (약학사) •1999년 2월 : 경희대학교 약학대학원 약학과 (약학석사) •2012년 8월 : 성균관대학교 약학대학원 약학과 (약학박사) •2013년 3월 ~ 현재 : 청주대학교 제약공학과 교수 |
|
<관심분야> 약물전달 시스템, 의약품 제조, 의약품 제형설계, 복합제 |
|
|
강 진 양(Chin-Yang Kang) [정회원] |
|
|
|
•1986년 8월 : 경희대학교 대학원 약학과 (제약화학 석사) •1995년 2월 : 경희대학교 대학원 약학과 (약제학 박사) •1997년 3월 ~ 현재 : 삼육대학교 약학대학 약학과 교수 |
|
<관심분야> 제약화학, 약제학, 약물전달시스템, 물리약학 |
|
|
강 창 민(Changmin Kang) [준회원] |
|
|
|
•2011년 3월 : 삼육대학교 약학과 입학 •2015년 2월 : 삼육대학교 약학과 졸업 (약학사) •2015년 3월 ~ 현재 : 삼육대학교 대학원 약학과 약제학 전공(석사과정) |
|
<관심분야> 약학, 약제학, 약물전달시스템 |
|
|
박 준 범(Jun-Bom Park) [정회원] |
|
|
|
•2001년 2월 : 삼육대학교 일반대학원 약학과 (약제학 석사) •2012년 8월 : 강원대학교 일반대학원 약학과 (약제학 박사) •2015년 3월 ~ 현재 : 삼육대학교 약학대학 약학과 조교수 |
|
<관심분야> 약학, 약제학, 약물전달시스템 |
|



