|
꿀벌부채명나방 성충 정소에 의한 아포리포포린-III의 흡수 |
|
윤화경 한서대학교 생명과학과
|
|
Apolipophorin-III uptake by the adult testes in the wax moth, Galleria mellonella |
|
Hwa-Kyung Yun Department of Biological Sciences, Hanseo University
|
|
요 약 아포리포포린-III (apoLp-III)를 꿀벌부채명나방 종령 유충 혈림프로부터 KBr 농도구배 초원심분리와 겔크로마토그래피(Sephadex G-100)를 이용하여 분리, 정제하였다. KBr 농도구배 초원심분리가 끝난 후, 리포포린을 제외한 분획 (lipophorin-free fractions)을 겔크로마토그래피 시료로 사용하였으며, 겔크로마토그래피를 행한후 sodium dodecyl sulfate (SDS)-전기영동으로 apoLp-III의 정제를 확인하였다. 또한, 본 연구에서는 유충 혈림프로부터 정제된 apoLp-III가 꿀벌부채명나방의 성충 정소에 의해 흡수되는 지를 조사하였다. 우화한 지 1일 또는 2일된 성충으로부터 성충 정소를 차가운 링거액에서 분리한 후 조직 배양의 시료로 사용하였다. 순수 정제한 apoLp-III를 dimethyl sulfoxide (DMSO)에 녹인 형광물질 fluorescein isothiocyanate (FITC)와 상온에서 계속 저어가면서 1시간 동안 배양하였다. FITC로 표지된 apoLp-III (FITC-labeled apoLp-III)를 Sephadex G-25 PD-10 column을 이용하여 정제하고 확인하였다. 정제된 FITC-labeled apoLp-III와 성충 정소 조직을 상온에서 30분간 배양하였다. 배양 후 형광현미경 (fluorescence Axioskop microscope)과 SDS-전기영동을 이용하여 FITC-labeled apoLp-III가 정소 조직으로 들어가는 지의 여부를 확인하였다. 그 결과 FITC-labeled apoLp-III가 성충 정소로 흡수된다는 사실을 알 수 있었다.
|
|
Abstract Apolipophorin-III (apoLp-III) was isolated and purified from the last larval hemolymph of Galleria mellonella by KBr gradient ultracentrifugation and gel chromatography (Sephadex G-100). After KBr gradient ultracentrifugation, the lipophorin-free fractions were used as the samples for gel chromatography. The purity of the finally purified apoLp-III was confirmed by SDS-PAGE after gel chromatography. In this study, we found that apoLp-III is taken up into the adult testes in Galleria mellonella. The testes were dissected from day-1 or -2 adults in cold Ringer's solution and used for tissue culture. The protein moiety of apoLp-III was labeled with FITC dissolved in dimethyl sulfoxide (DMSO) at room temperature under conditions of continuous stirring for 1 h. The FITC-labeled apoLp-III was purified with a Sephadex G-25 PD-10 column. The tissues of the adult testes were incubated at room temperature for 30 min with fluorescein isothiocyanate (FITC)-labeled apoLp-III. Fluorescein microscopy and sodium dodecyl sulfate (SDS)-polyacrylamide gel electrophoresis (PAGE) revealed that the adult testis tissues internalize the FITC-labeled apoLp-III. The results showed that apoLp-III is taken up by the adult testes.
Keywords : apolipophorin-III, testes, FITC, SDS-PAGE |
![]() 1. 서론
1. 서론
곤충은 짧은 생활주기와 개체수의 대량번식이 용이하기 때문에 실험재료로 이용되어 왔으며, 아포리포포린-I과 아포리포포린-II로 구성된 고밀도 리포포린은 곤충 혈림프내에서 지질을 운반하는 데 중요 역할을 담당하는 단백질이다. 제3의 소단위인 아포리포포린-III는 분자량이 18 kDa정도인 단백질로 고밀도 리포포린을 둘러싸 소수성인 표면을 만들어 더욱 많은 양의 지질을 에너지 이용 장소인 생식소 (난소와 정소)와 비행근으로 운반하는 데 중요한 역할을 한다 [1]. 또한, 비행근에서 리포포린 리파아제의 작용에 의해 디아실글리세리드 (DAG)가 제거되면 아포리포포린-III가 리포포린의 표면으로부터 떨어져 나옴으로서 혈림프로부터 디아실글리세리드의 재수송작용을 도와주는 기능도 지니고 있다 [2, 3]. 그리고 유충 중장에서 고밀도 리포포린은 DAG의 운반을 용이하게 하고, DAG를 지방체로 운반하여 트리아실글리세리드 (TAG)의 형태로 저장하는 것을 도와주는 역할도 한다고 알려져 있다 [4, 5]. 리포포린은 아포리포포린-I과 II로 구성되어 있는 고밀도 리포포린과 이 고밀도 리포포린에 아포리포포린-III가 결합된 저밀도 리포포린이 존재하는 데, 저밀도 리포포린은 많은 양의 지질을 곤충이 비행시 필요한 많은 양의 에너지 로 제공한다. 또한 곤충이 난자형성에 필요한 에너지를 공급하기 위하여 지질 뿐만 아니라 리포포린과 아포리포포린-III도 난소로 흡수된다는 사실이 최근에 밝혀졌다 [4]. 난소에 존재하는 대부분의 단백질은 지방체에서 합성되어 난소로 흡수되며, 흡수되는 과정은 수용체-매개 내포작용으로 일어난다는 사실이 보고 되어 있다 [5]. 또한 일부 소량의 단백질은 난소자체에서 합성하기도 한다고 알려져 있다 [6-8]. 아포리포포린-III가 난소에 에너지를 공급하기 위하여 흡수된다는 사실은 밝혀졌지만 수컷 성충의 경우 에너지 공급을 위해 정소에서의 역할은 아직 밝혀지지 않았다. 따라서 본 연구는 꿀벌부채명나방의 종령 유충 혈림프로부터 아포리포포린-III를 KBr 농도구배 초원심분리와 겔크로마토그래피를 이용하여 분리, 정제한 후 형광물질 fluorescein isothiocyanate (FITC)로 표지한 아포리포포린-III (FITC-apoLp -III)를 제작하였다. 제작한 FITC-apoLp-III를 성충 정소와 상온에서 30분간 배양하여 아포리포포린-III가 성충 정소로 흡수되는지를 조사하였으며, 이 결과를 형광현미경과 SDS - polyacryl- amide gel electrophoresis (PAGE)를 이용하여 확인하였다.
2. 본론
2.1 곤충
꿀벌부채명나방 (Galleria mellonella) 유충을 자연사료 (소비)와 혼합한 인공 사료를 Han et al., [9]방법으로 배양하였다. 배양조건은 온도 32±1℃, 상대습도 75±5%, 광주기는 16시간 광조건과 8시간 암조건으로 사용하였다.
2.2 혈림프와 성충 정소의 적출
혈림프는 항응고 완충용액 (128 mM NaCl, 1.8 mM CaCl2, 1.3 mM KCl, and 30 mM trisodium-citrate, pH 6.4)이 들어있는 차가운 튜브에 핀셋을 이용하여 유충 앞다리로부터 혈림프를 추출하였다. 추출한 혈림프의 암화를 방지하기 위해 phenylthiourea (PTU)를 넣고 12,000 g (4℃)에서 5분 동안 혈구와 세포 잔유물을 제거하기 위해 원심분리한 후 상등액만을 취하여 사용할 때까지 -70℃에서 보관하였다.
정소는 차가운 링거액 (128 mM NaCl, 1.8 mM CaCl2, 1.3 mM KCl, pH 7.4)이 들어 있는 튜브에서 성충으로부터 해부하여 적출한 후 즉시 조직배양의 시료로 사용하였다.
2.3 아포리포포린-III의 정제
13 ㎖ 용량의 초원심분리용 튜브에 2.64 g의 KBr과 2 ㎖의 종령 유충 혈림프와 0.1 M PBS (0.1 M sodium phosphate, 0.15 M NaCl, 5 mM EDTA, pH 7.0)을 넣고 잘 혼합하여 최종밀도가 1.31 g/㎖이 되게 한 후, 그 용액 위에 0.9 % NaCl (밀도 1.007 g/㎖)을 넣어 최종부피가 13 ㎖이 되게 하여 Beckman사의 초원심분리기 (XL-90) SW 41 Ti rotor에 넣고 4 ℃에서 40,000 rpm으로 16시간 동안 초원심분리하였다. 초원심분리가 끝난 후 리포포린을 제외한 분획 (lipophotin-free fraction)을 겔크로마토그래피용 시료로 사용하였다.
초원심분리후 리포포린을 제거한 분획을 겔크로마토그래피 (Sephadex G-100)을 행하였으며, column은 2 x 60 ㎝, flow rate는 30 ㎖/h으로 각 분획은 2 ㎖씩 취하였다. 용출 완충액으로는 0.05 M phosphate buffer (pH 7.0)를 사용하였으며, 각 분획을 분광광도계 (Shimadzu UV-120)로 280 nm에서 흡광도를 측정하였다. 아포리포포린-III가 존재하는 분획을 농축하여 정량한 후 최종적으로 분리된 아포리포포린-III를 SDS-PAGE를 이용하여 순수도를 확인하였다.
2.4 전기영동
SDS-PAGE는 Laemmli (1970) [10]방법에 따라 10% gel에서 이행하였다. 전기영동 후에 gel은 coomassie blue R 250으로 염색하였으며, 3.5% 아세트산을 포함한 30% 메탄올 용액으로 탈색하였다.
2.5 FITC-apoLp-III의 제조 및 정소와의 배양
순수 정제한 아포리포포린-III (1 ㎎/㎖)를 dimethyl sulfoxide (DMSO)에 녹인 형광물질 fluorescein isothiocyanate (FITC, 20 ㎕/㎖)와 상온에서 1시간 동안 배양하였다 [11]. FITC로 표지된 아포리포포린-III (FITC-apoLp-III)를 Sephadex G-25 PD-10 column (Amersham Phamacia Biotech, Piscataway, NJ, USA)을 이용하여 정제하였다.
정제한 FITC-apoLp-III (25 ㎍/㎖)와 정소 조직을 상온에서 30분 동안 배양하였다. 배양 후 정소 조직을 식염수로 3번 세척하였으며 4% paraformaldehyde로 10분에서 30분정도 상온에서 고정하였다.
2.6 형광현미경 관찰
조직배양이 끝난 정소를 형광현미경 (Zeiss, Jena, Germany)을 사용하여 관찰하였다. UV필터를 사용하여 형상은 AxioCam HRc 디지털 카메라로 관찰하고, Axio Vision Release 4.5 software (Zeiss)를 이용하여 기록하였다[11].
3. 결론
3.1 아포리포포린-III의 분리 및 정제
종령 유충 혈림프 2 ㎖을 KBr 농도구배 초원심분리를 한 후 리포포린을 제거한 분획을 Yun (2013) [12]의 방법대로 행하여 정제된 아포리포포린-III를 시료로 사용하였다. 유충 혈림프에는 리포포린에 결합하지 않은 형태의 아포리포포린-III가 존재하기 때문에 리포포린을 제거한 후 정제를 하는 것이 다른 단백질로부터 오염을 방지하는 좋은 방법이다. 따라서 본 실험에서는 KBr 농도구배 초원심분리를 행하여, 리포포린을 제거한 KBr 농도구배 초원심분리 분획 (Lp-free fraction)을 겔크로마토그래피 (Sephadex G-100)의 시료로 사용하였다. 그 결과 높은 흡광도를 보여주는 2개의 피크가 존재하였다 [Fig. 1].
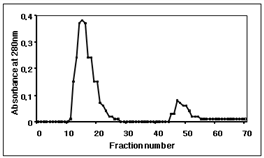
Fig. 1. Sephadex G-100 gel chromatogaphy of the lipophorin-free fraction from KBr density gradient ultracentrifugation. The column was eluted 0.05 M phosphate buffer at a rate of 30 ㎖/h and the eluents were collected in 2.0 ㎖ fractions.
2개의 피크에 해당되는 분획을 전기영동한 결과 첫 번째 피크의 분획(Fig. 2의 12-20)에 아포리포포린-III가 존재하였으며 순수정제가 되었음을 알 수 있었고 [Fig. 2], 두 번째 분획(Fig.2의 49)에는 단백질이 없음을 확인하였으며 피크가 형성된 것은 염(salts)들이 존재하는 것으로 사료된다.

Fig. 2. SDS-PAGE of Sephadex G-100 gel chromatogaphy. Numbers are each farctions.
3.2 FITC-labeled-아포리포포린-III의 제조
순수 정제한 아포리포포린-III (1 ㎎/㎖)를 dimethyl sulfoxide (DMSO)에 녹인 형광물질 fluorescein isothiocyanate (FITC, 20 ㎕/㎖)와 상온에서 1시간 동안 배양하였다. FITC로 표지된 아포리포포린-III (FITC- apoLp-III)를 Sephadex G-25 PD-10 column 을 이용하여 정제한 후 Yun (2009) [1]의 방법대로 확인하였다 [Fig. 3의 P].
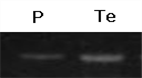
Fig. 3. SDS-PAGE of fluorescein isothiocyanate (FITC)- labeled apoLp-III(p) and adult testes extracts (Te). FITC-labeled apoLp-III was present in the adult testes extracts.
3.3 아포리포포린-III의 성충 정소에 의한 흡수
아포리포포린-III가 성충 정소로 흡수되는 지를 확인하기 위하여 정제한 FITC-apoLp-III (25 ㎍/㎖)와 성충 정소 조직을 상온에서 30분 동안 배양하여 전기영동과 형광현미경으로 확인하였다. 그 결과 아포리포포린-III가 성충 정소내로 흡수된다는 사실을 확인하였다 [Fig. 3의 Te와 그림 4].
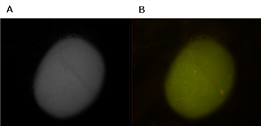
Fig. 4. Fluorescence microscopic image of the adult testes tissues(B) obtained with fluorescein isothiocyanate (FITC). (A) shows differential interference contrast (DIC) image of the same frame represented in (B).
4. 토론
곤충의 주요 혈림프 단백질인 리포포린은 많은 지질을 흡수기관에서 저장 및 이용기관으로 지질을 운반한다. 특히 리포포린은 디아실글리세리드 (DAG)과 콜레스테롤의 저장기관인 지방체에서 이용기관인 난소로 운반하여 알 성숙 과정 중에 일어나는 난황단백질의 형성에 필요한 물질을 제공한다고 보고되었다 [3, 4, 6]. 리포포린 자체의 내포작용 또한 다양한 곤충에서 일어난다는 사실도 밝혀져 있다 [5]. 일반적으로 곤충은 AKH (Adipo-kinetic hormone)을 주입하면 많은 양의 지질을 비행근으로 운반하는데, 이때에 아포리포포린-I과 아포리포포린-II로 구성되어 있는 고밀도 리포포린에 제3의 소단위인 아포리포포린-III가 결합하여 저밀도 리포포린으로 전환된다. 저밀도 리포포린은 더욱 많은 양의 지질을 에너지 사용기관으로 운반한다. 고밀도 리포포린은 지질 뿐만 아니라 리포포린 자체도 난소나 정소로 세포내작용에 의해서 들어가 에너지나 영양분 생성에 사용된다고 밝혀져 있다 [7, 8]. 따라서 본 연구 에서는 아포리포포린-III를 꿀벌부채명 나방의 종령 유충 혈림프로부터 분리, 정제하여 이들이 성충 정소로 흡수되는 지를 형광현미경과 전기영동을 이용하여 조사하였다. 또한 아포리포포린-III도 저밀도 리포포린이 지질을 운반하는데 중요한 역할을 한다는 사실은 이미 밝혀져 있으나 에너지원으로 직접 이용된다는 보고는 최근에서야 알려지기 시작하였다. 그리고 아포리포포린-III가 꿀벌부채명나방의 성충 난소로 직접 흡수되어 에너지원으로 사용된다는 사실도 밝혀졌다 [1]. 본 연구는 꿀벌부채명나방의 아포리포포린-III를 정제하여 형광물질인 FITC를 표지한 FITC-apoLp-III를 제작하여 성충 정소와 조직배양을 하여 아포리포포린-III가 성충 정소로 흡수되는 지의 여부를 조사하였다. 형광현미경으로 조직배양한 성충 정소를 확인한 결과 정소내에 형광물질이 존재하는 것으로 보아 아포리포포린-III가 성충 정소내로 흡수된다는 새로운 사실을 찾아내었다 [Fig. 3, 4]. 이미 밝혀진 바와 같이 고밀도 리포포린이 에너지를 필요로 하는 기관인 난소, 정소 및 비행근으로 지질을 운반하는 기능 뿐만 아니라 고밀도 리포포린 자체도 에너지원으로 이용된다. 따라서 본 연구의 결과로 아포리포포린-III가 성충 정소로 흡수된다는 사실은 정자형성과정에 필요한 단백질 기본단위인 아미노산을 이용할 수 있는 단백질로서 활용이 가능하다는 새로운 사실을 밝혀냈다는 것이 중요하다. 또한 앞으로 흡수된 아포리포포린-III가 성충 정소내에서 어떤 단백질과 기관을 형성하는 데 이용을 하는 것인지를 밝혀내는 것이 앞으로 해야 할 과제이며, 산림에 많은 피해를 주는 해충 방제에 중요한 자료를 제공함으로써 환경 피해를 줄일수 있을 것으로 사료된다.
References
[1] H.K. Yun, "Apolipophorin-III uptake by the adult ovary in the wax moth Galleria mellonella", Journal of The Korean Academia-Industrial cooperation Society, vol. 10, no. 3, pp. 620-624, 2009.
[2] J.K. Kawooya, D.J. Van der Horst, M.C. Van Heusden, B.L. Brigot, R. Van Antwerpen, J.H. Law, “Lipophorin structure analyzed by in vitro treatment with lipase”. J. Lipid Res. 32, pp. 1781-1788, 1991.
[3] M.C. Van Heusden, D.J. Van der Horst,, J.K. Kawooya, J.H. Law. “In vivo and in vitro loading of lipid by artificially lipid-depleted lipophorins : evidence for the role of lipophorin as a reusable lipid shuttle” J. Lipid Res. 32, pp. 1789-1794, 1991.
[4] Z.E. Jouni, H.K. Yun, M.A. Wells, "Cholesterol efflux from larval Manduca sexta fat body in vitro: high-density lipophorin as the receptor", J. Insect Physiol., 48, pp. 609–618, 2002.
DOI: http://dx.doi.org/10.1016/S0022-1910(02)00081-1
[5] R. Ziegler, R.V. Antwerpen, "Lipid uptake by insect oocytes", Insect Biochem. Mol. Biol., 36, pp. 264–272, 2006.
DOI: http://dx.doi.org/10.1016/j.ibmb.2006.01.014
[6] H.K. Yun, "The transfer of diacylglycerol from lipophorin to fat body in larval Manduca sexta" Journal of The Korean Academia-Industrial cooperation Society, vol. 12. no. 4, pp. 1770-1774, 2011.
DOI: http://dx.doi.org/10.5762/KAIS.2011.12.4.1770
[7] E.S. Jung, J.H. Joe, H.K. Yun, "Lipophorin uptake by the laval fat body and adult ovary in the wax moth, Galleria mellonella", Entomol. Res., 36, pp. 167–171, 2006.
DOI: http://dx.doi.org/10.1111/j.1748-5967.2006.00028.x
[8] E.S. Jung and H.K. Yun, “Receptor-mediated endocytosis of lipid and lipophorin by the larval fat body, adult ovary and testis in the wax moth Galleria mellonella”, Entomol. Res., 37, pp. 60-65, 2007.
DOI: http://dx.doi.org/10.1111/j.1748-5967.2007.00054.x
[9] J. Han, C.S. Lee, C.Y. Yun, B.H. Lee, Y.G. Ko, C.S. Kang, S.D. Lee, J.S. Hwang, S.W. Kang, H.R. Kim, “Cloning and expression of male-specific protein (MSP) from the hemolymph of greater wax moth, Galleria mellonella L.”, Arch. Insect Biochem. Physiol. pp. 110-120, 2003.
[10] U.K. Laemmli, “Cleavage of structural proteins during assembly of the head of bacteriophage T4”, Nature, pp. 680-685, 1970.
[11] D. Van Hoof. K.W. Rodenburg, D.J. Van der Horst, "Lipophorin receptor-mediated lipoprotein endocytosis in insect fat body cells", J. Lipid. Res., 44, pp. 1431–1440, 2003.
[12] H.K. Yun, “Apolipophorin-III uptake by the last larval fat body in the wax moth Galleria mellonella”, Journal of The Korean Academia -Industrial cooperation Society, vol. 14. no. 8, pp. 4106-4110, 2013.
DOI: http://dx.doi.org/10.5762/KAIS.2013.14.8.4106
|
윤 화 경(Yun, Hwa-Kyung) [정회원] |
|
|
|
•1986년 2월 : 고려대학교 생물학과 (이학사) •1991년 8월 : 고려대학교 생물학과 대학원 (이학석사) •1995년 2월 : 고려대학교 생물학과 대학원 (이학박사) •1995년 3월 ~ 현재 : 한서대학교 생명과학과 교수 |
|
<관심분야> 동물생리 및 지질대사, 환경생태학, 곤충생리생화학 |
|