|
야관문(Lespedeza Caneata) Ethanol 추출물이 알코올 투여한 생쥐의 간장에 미치는 영향 |
|
정민주1, 정경아2* 1조선대학교 생명과학과, 2동신대학교 작업치료학과
|
|
Effects of Lespedeza Caneata ethanol extract on the liver of alcohol administered Mice |
|
Min-Ju Cheong1, Kyoung-A Chung2* 1Dept. of life science, Chosun University 2Dept. of Occupational Therapy, Dongshin University |
|
요 약 본 연구는 야관문 추출물이 알코올 투여된 생쥐의 간장에 미치는 영향을 알아보고자 시행하였다. 대조군(Con), 알코올투여군(AL) 알코올-야관문 200 ㎎/kg 투여군 (AL-LC 200군), 알코올-야관문 400 ㎎/kg투여군 (AL-LC 400군)으로 나누어 구분하였다. 대조군과 알코올투여군은 1차 증류수를 알코올-야관문 투여군은 야관문을 각각 200 ㎎/kg과 400 ㎎/kg 농도로 10 일간 경구투여 하였다. 모든 실험군은 경구투여 7일후 12시간 절식시킨 다음 대조군은 1차 증류수, 알코올투여군과 알코올-야관문투여군은 50% ethanol (MERCK, USA)을 10 g/kg농도로 12시간 간격으로 5회 경구투여 하였다. 혈액의 AST, ALT효소활성과 간장의 조직학적 실험을 하여 다음과 같은 결론을 얻었다. AST, ALT은 AL군 보다 알코올-야관문 복합투여군에서 수치가 감소하였다. 특히 AST 활성은 AL군에 대하여 AL-LC 200군과 AL-LC 400군 모두 활성이 유의적으로 감소하였다. 조직학적 결과는 간장에서 AL군은 대부분에서 괴사와 변형이 일어났고 중심정맥 주변 간세포 내에 지방방울이 축적되었다. AL-LC 200군에서는 중심정맥의 일부가 부풀어진 모습을 보였고 간세포의 팽창과 작은 지방 방울이 축적되었다. AL-LC 400군에서는 중심정맥은 정상적인 모습을 보이며 일부 간세포내의 작은 지방 방울이 축적 되었고 대부분은 정상적인 모습을 보였다. 이상의 연구결과로 보아 야관문 추출물이 알코올투여한 생쥐의 간장손상에 대한 보호 효과가 있어 기능성 건강 소재로서의 활성 용도가 높을 것으로 사료된다.
|
|
Abstract This study was conducted to investigate the effects of Lespedeza caneata extract on the livers of alcohol-administered mice. The study subjects were divided into a control (Con), alcohol administration (AL), alcohol and Lespedeza Caneata extract 200 ㎎/kg administration (AL-LC 200), and alcohol and Lespedeza caneata extract400 ㎎/kg administration (AL-LC 400) group. Distilled water was administrated orally to control and alcohol groups for ten days, while Lespedeza caneata extract was administered orally to alcohol and Lespedeza caneata extract groups for ten days. All experimental groups were fasted for twelve hours seven days after the oral administration, after which distilled water was administered orally to Con five times at twelve-hour intervals. At the same time, 50% ethanol (MERCK, USA) at 10 g/kg concentration was administered orally to AL and AL-LC groups five times at 12-hour intervals. The AST, ALT enzyme activation in blood and histology of the liver were then evaluated. AST and ALT in AL-LC groups were lower than in the AL group. Particularly, the AL-LC 200 and AL-LC 400 groups had significantly lower AST activation than the AL group. Histological results showed that most of the subjects in the AL group had necrosis and deformation in their livers, while fat droplets were accumulated in hepatic cells around the central vein. AL-LC 200 group revealed that a portion of the central vein was swollen, liver cells were expanded, and small fat droplets were accumulated. In the AL-CL 400 group, the central vein was normal and small fat droplets were accumulated in some liver cells. However, most of the liver cells appeared normal in the AL-CL 400 group. These results suggest that the extracts of Lespedeza caneata prevented alcohol induced liver damage in mice and have great potential for use as natural health products.
Keywords : ALT, AST, alcohol, Lespedeza Caneata extract, liver |
![]()
1. 서론
현대사회의 복잡성과 계속적인 스트레스로 말미암아 알코올의 소비가 증가되는 추세에 있다. 알코올은 ethyl alcohol 과 methyl alcohol로 대별되며 methyl alcohol은 formic acid 및 유기산 생성으로 인해 산증 유발, 망막손상 및 중추신경 손상으로 인하여 ethyl alcohol만이 음료나 의약품으로 사용되고 있다[1]. 세계보건기구(WHO)가 발표한 ‘술과 건강에 대한 세계 현황 보고서 2014’에 따르면 우리나라 1인당 연간 알코올 소비량이 세계 190개국 중 15위, 아시아에선 1위로 나타났다[2]. 또한 우리나라는 도수가 높은 증류주로만 보면 세계 1위로 나타났을 뿐만 아니라 1인당 한국인의 알코올 소비량도 감소하지 않으며 오히려 늘어나고 있는 추세이다[3]. 알코올의 섭취는 소화관 점막을 손상시켜 영양학적인 문제를 일으킬 뿐만 아니라 소화기 계통, 순환기 계통, 신경계통 등 전신에 유해한 손상을 일으킨다[4, 5, 6]. 흡수된 알코올의 대부분이 간장에서 대사되기 때문에 다른 기관에 비하여 많은 영향을 받는다. 간장은 우리 몸에서 가장 큰 샘으로 문맥으로 운반된 영양분의 저장과 분해, 혈당조절, 3대 영양소 대사 작용, 쓸개즙 생산, 혈액량 조절, 혈액응고인자 생산, 방어, 재생 및 해독 작용 등 여러 기능을 하는 것으로 알려져 있다[7]. 섭취된 알코올은 간 내에서 alcohol dehydrogenase (ADH)에 의해 Hydrogen 과 acetaldehyde로 산화되고 Hydrogen 증가는 lactate생산을 증가시켜 간 내에 collagen 생산을 증가 시키고 acetaldehyde는 단백질 축적과 지질과산화 촉진 등 유독 작용을 일으킨다[1]. 알코올로 인하여 간 고유의 기능을 상실하면 간세포의 변성 및 괴사, 지방축적, 간 효소의 누출 등의 간 손상을 유도하여 지방간, 간염, 간경화증, 간암과 같은 간질환이 발생하게 된다[8, 9,10].
우리나라 사람들은 서양인에 비하여 알코올 분해 효소의 활성이 낮아 많은 양의 알코올 섭취는 건강상의 문제 일으킬 수 있다[11]. 이러한 이유로 우리나라에서는 알코올로 인한 질병이나 유해 작용을 해소시키고 해독을 도와주거나 숙취를 경감시키기 위한 연구가 활발하게 진행되고 있다[3,8,12]. 특히 식품분야에서는 염증 반응성을 감소시키거나 무력화할 수 있는 약물의 발굴과 활용에 커다란 관심을 가지고 우리 주변에서 볼 수 있는 으름열매[13], 헛개나무[14], 머위[15], 모링가[16], 오미자[17], 산겨릅[18] 등과 같은 천연물질에 관한 연구가 진행되고 있다.
야관문(Lespedeza Caneata)은 콩과 싸리속에 속한 여러해 살이 식물로 우리나라와 일본, 중국을 비롯한 인도 등지에 분포하며 비수리, 삼엽초로 불리워지고 있다[19]. 예로부터 민간에서는 발기부전, 조루, 정액루, 기침, 천식 등의 치료에 효능이 있는 약재로 사용되었으며, 야관문의 생리활성 물질로는 pinitol, flavonoid, phenol성분, tannin 및 β-sitosterol을 함유하며, flavonoid 중에서도 quercetin, kaempferol, vitexin, orientin등을 함유하는 것으로 보고되고 있다[20-23].
주요 약리 작용으로 간과 콩팥을 보호해주고 폐 기능강화와 혈액순환에 효능이 있으며, 창상[24], 항염[25], 항산화[23], 및 미백[26], 해독[27]의 효과가 있다고 보고되고 있다.
따라서 본 연구에서는 알코올의 섭취 후에 나타나는 증상에 대하여 예방할 수 있는 천연물질에 대한 관심이 높아져 여러 가지 생리활성 물질을 가지고 있으나 숙취 해소 능 및 간세포 보호 효과에 대한 연구는 상대적으로 미흡한 실정인 야관문 추출물을 이용하여 급성 알코올성 간 손상된 생쥐에서의 간 보호 효능을 확인하고자 시도되었다
2. 재료 및 방법
2.1 야관문 추출액 제조
야관문 잎과 줄기는 전남생약농업협동조합( 전남 화순)에서 구입하여 이물질을 제거하고 식물체 파쇄기 (우주과학, 한국)를 이용하여 파쇄하였다. 시료는 Kim & Hong[28]의 최적 추출조건 방법을 변용하여 야관문 50 g에 10배량의 60% ethanol을 가하여 83℃의 heating mantle (EAM9203-06, M-top, 한국)상에서 6시간 추출하였다. 추출액을 Wathman NO.2 여과지를 이용하여 여과한 후 감압증류장치 (EYELA N-1000, Tokyo, Japan)로 농축하고, 동결건조기 (FD8508, Ilshin, Dongducheon, Korea)를 이용하여 건조하여 총 5 g의 분말을 얻어 약 10%의 수득율을 얻었다.
2.2 실험동물 및 식이
본 실험에 사용한 실험동물은 7주령 된 수컷 ICR 마우스(30 g)로 오리엔탈로부터 공급받아 사료와 물은 충분히 공급하고 온도 22±2℃, 습도 55±15%, 12시간-12시간(light-dark cycle)의 환경이 조절되는 실험동물센터에서 1주일 적응시킨 후 실험에 사용하였다. 이 동물실험은 조선대학교 동물실험 윤리위원회의 승인(승인번호: CIACUC2016-A0006)을 받아 동물 윤리 준칙에 의거하여 실험하였다.
실험군은 대조군 (Con군), 알코올투여군 (AL군), 알코올-야관문 200 ㎎/kg 투여군 (AL-LC 200군), 알코올-야관문 400 ㎎/kg투여군 (AL-LC 400군)으로 각 군에 5마리씩 무작위로 나누었다. 정상군과 알코올투여군은 1차 증류수를 알코올-야관문 투여군은 야관문을 각각 200 ㎎/kg과 400 ㎎/kg 농도로 10 일간 경구 투여 하였다. 모든 실험군은 경구 투여 7일후 12시간 절식시킨 다음 대조군은 1차 증류수, 알코올투여군과 알코올-야관문투여군은 50% ethanol (MERCK, USA)을 10 g/kg농도로 12시간 간격으로 5회 경구투여 하였다. 최종 투여 3시간 후 혈액과 조직을 채취하였다.
2.3 혈액 내 효소활성도 측정
실험 종료 후 24시간 절식시킨 다음 ether로 마취한 상태에서 심장 천자법을 이용하여 채혈 한 다음 혈액을 40분간 상온에서 굳힌 후 3000 rpm에서 15분간 원심 분리하여 혈청을 분리한 후 혈액자동분석기(Roche cobas c 702)를 이용하여
(1) AST (Aspartate aminotransferase) 활성 측정은 실험관에 혈청 20 ㎕과 AST kit R1 250 ㎕과 AST kit R2 50 ㎕를 혼합하여 파장 340 nm에서 흡광도를 측정하였다.
(2) ALT (Alanin aminotransferase) 활성 측정은 실험관에 혈청 20 ㎕과 ALT kit R1 250 ㎕과 ALT kit R2 50 ㎕를 혼합하여 파장 340 nm에서 흡광도를 측정하였다.
2.4 조직학적 관찰
간장조직을 떼어내어 10% 중성포르말린에 72시간 고정시킨 후 24시간동안 흐르는 물에 수세하고, 저농도(70%)부터 고농도(100%) alcohol 단계를 거쳐 탈수 과정을 거친 후 xylene으로 투명화하고, paraffin으로 포매하였다. 블록을 마이크로톰 (820, american optical, USA)을 이용하여 6 ㎛의 두께로 절편을 만들었다. 슬라이드는 xylene으로 paraffin을 제거 후 고농도(100%)부터 저농도(70%) alcohol을 거쳐 함수시킨 후 증류수에 수세하였다. hematoxylin- eosin(H&E)염색을 실시하였다.
2.5 통계처리
실험 성적은 평균값과 표준편차 (mean±Stand)로 표시하였고, 각 시료군 간의 통계적 분석은 본 실험에서 얻은 결과는 independent t-test를 이용하여서 각 그룹 간 통계적 유의성을 검정하였다. 각 군의 유의성은 p<0.05 수준으로 검정하였다.
3. 결과
3.1 AST에 미치는 영향
대조군(Con군)은49.67±4.73 U/L, 알코올 단독투여군(AL군)은 117.33±1.15 U/L, 알코올-야관문200 ㎎/Kg투여군(AL-LC 200군)은 77.33±13.43 U/L, 알코올-야관문400 ㎎/Kg투여군(AL-LC 400군)은 61.00±6.56 U/L로 나타났다. 모든 실험군은 대조군에 비하여 활성이 증가 하였다. 특히 AL군과 AL-LC 400군은 유의적으로 변화하였다. AL군에 대하여 AL-LC 200군과 AL-LC 400군은 활성이 유의적으로 감소하였다(Fig. 1. Table 1).
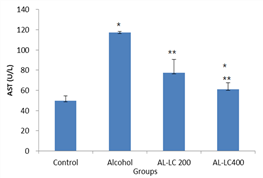
Fig. 1. The actives of AST in mice treated 50% ethanol a nd/or Lespedeza Caneata extract Control : Alcoh ol no treatment, Alcohol: Alcohol treatment, AL- LC 200: Alcohol and Lespedeza Caneata extract tr eatment (200 ㎎/Kg), AL-LC 400: Alcohol and Lespedeza Caneata extract treatment (400 ㎎/Kg). values are mean±SD (n=5).
Significant differences were compared with control at *p<0.05
Significant differences were compared with alcohol at **p<0.05
3.2 ALT에 미치는 영향
Con군은 38.33±1.53 U/L, AL군은57.00±21.63 U/L, AL-LC 200군은30.33±8.08 U/L, AL-LC 400군은 29.67±6.35 U/L로 나타났다. AL군은 Con군에 비하여 활성이 즈 높았다. 야관문을 투여한 AL-LC 200군과 AL-LC 400군은 Con군에 비하여 활성이 낮았다. 특히 AL-LC 400군은 유의적으로 감소하였다(Fig. 2, Table 1).
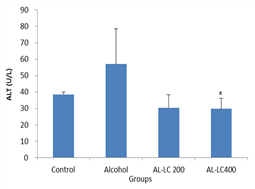
Fig. 2. The actives of ALT in mice treated 50% ethanol a nd/or Lespedeza Caneata extract. Control : Alcoh ol no treatment, Alcohol: Alcohol treatment, AL-L C 200: Alcohol and Lespedeza Caneata extract tre atment (200 ㎎/Kg), AL-LC 400: Alcohol and Lesp edeza Caneata extract treatment (400㎎/Kg). values are mean±SD (n=5). Significant differences were c ompared with control at *p<0.05
Table 1. Blood Chemistry in mice treated 50% ethanol an d/or Lespedeza Caneata extract
|
Groups |
AST (U/L) |
ALT( U/L) |
|
Control |
49.67±4.73 |
38.33±1.53 |
|
Alcohol |
117.33±1.15 * |
57.00±21.63 |
|
AL-LC 200 |
77.33±13.43 ** |
30.33±8.08 |
|
AL-LC 400 |
61.00±6.56 *, ** |
29.67±6.35* |
Control : Alcohol no treatment, Alcohol: Alcohol tre atment, AL-LC 200: Alcohol and Lespedeza Cane ata extract treatment (200 ㎎/Kg), AL-LC 400: Alc ohol and Lespedeza Caneata extract treatment (400 ㎎/Kg). values are mean±SD (n=5).
Significant differences were compared with control at *p<0.05
Significant differences were compared with alcohol at **p<0.05
3.3 조직학적 결과
Con군은 중심정맥을 중심으로 하여 방사선모양으로 동모양혈관이 배열되고 주변으로 간세포가 관찰되었다(Fig. 3-A).
AL군에서는 중심정맥은 내막층 분리되거나 절단되고 위축되는 불규칙적인 모양을 보였다. 중심정맥 주변의 간세포들은 팽창되고 소엽 주변 세포에서는 일부 핵은 응축되어 괴사가 진행 되었다. 또한 중심정맥 주변 간세포 내에 지방방울이 축적되었다(Fig. 3-B).
AL-LC 200군에서는 중심정맥의 일부가 부풀어진 모습을 보였고 간세포의 팽창과 작은 지방 방울이 축적되었다(Fig. 3-C).
AL-LC 400군에서는 중심정맥은 정상적인 모습을 보이며 일부 간세포내의 작은 지방 방울이 축적 되었고 대부분은 정상적인 모습을 보였다 (Fig. 3-D).
4. 고찰 및 결론
알코올성 음료의 주성분인 ethanol의 섭취는 혈중 알코올 농도, 감수성, 섭취 조건 등에 따라 생체가 영향을 받아 기능이 일시적으로 장애되는 상태가 나타난다[6]. 그중에서 간장에 심각한 상해를 일으키며 전체 간 질환의 50-60%가 알코올성 질환과 관련 있다고 보고되어 지며 국내 1인당 알코올 소비수준이 점차적으로 증가함에 따라 알코올 섭취 후 체내에 남아있는 알코올은 간 효소 작용에 의해 해독 되어 지거나 간기능의 손상이나 장애가 나타나 간 병변으로 진행되어진다[29-31].
AST, ALT 효소활성은 정상상태에서는 효소의 활성이 낮지만 화학약품의 중독, 세균의 감염, 종양 혹은 저산소증으로 간세포가 손상을 받게 되면 간 조직은 괴사 등 여러 가지 병변이 유발되어 간세포에서 혈액으로 유출되어 활성이 증가된다. 혈청 중 AST, ALT은 간 기능검사를 위해 임상실험에서 널리 이용되고 있다[32]. 본 연구에서도 실험조건에 따른 간 손상을 확인하고자 간장 장애의 지표가 되는 AST, ALT 활성 여부를 확인하였다. 본 연구에서 AST 활성은 대조군에 비하여 실험군 모두 활성이 높았다. 특히 AL군과 AL-LC 400군은 유의적인 증가를 나타났다. ALT 활성은 AL 군에서 활성이 증가하였고 야관문 투여군에서는 활성이 감소하였다. Kim 등의[3] 급성 알콜성 간 손상에서 정상군에 비하여 알코올 투여군과 알코올-후코이단 투여군 모두 AST, ALT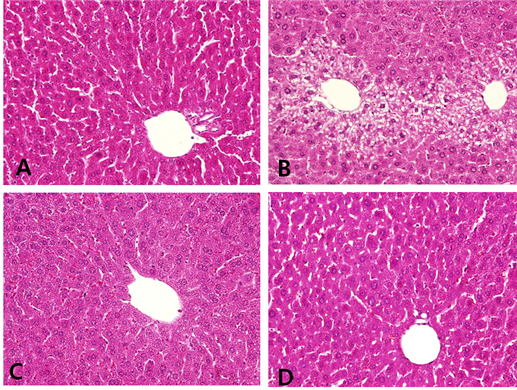
Fig. 3. Histopathological changes of hepatic cell in mice treated 50% ethanol and/or Lespedeza Caneata extract (H&E stain, X200)
활성도가 상승하였고, Kim 등[33]의 알코올 유도 간손상 실험에서 정상군에 비해 실험군인 알코올군과 알코올-지구자 열수추출물군 모두 AST, ALT활성도가 증가하여 본 연구의 AST 활성에서는 일치하였다. 본 연구에서 AL군에 비하여 AL-LC 200군과 AL-LC 400군에서 AST, ALT 활성이 감소 하였으며, AST 효소 활성은 유의적인 감소를 하였다. Kim 등의[3] 알코올 투여군과 후코이단 투여군비교에서는 AST, ALT 활성이 알코올 단독 투여군에 비하여 알코올 후코이단 투여군에서 감소하였다. Kim등[34]의 실험군 간의 비교에서 AST, ALT 활성이 알코올단독군에 비하여 지구자 추출물군이 감소하였다. 후코이단을 투여한 실험[3]과 지구자 열수추출물의 실험[33]과 유사 하였다.알코올성 간질환의 조직학적 초기에는 간세포의 지방증(steatosis)으로 작은 지방방울에서 큰 지방방울로 진행되면서 지방간염(steatohepatitis), 알코올성 간질환의 마지막 단계인 간조직의 섬유화에 의한 간경변증(steatofibrosis)으로 조직학적 변화가 일어난다[34, 35].
알코올성 간 손상에서 보여주는 육안적인 특징으로 Koneru등[36]의 알코올에 의한 간 손상 실험에서 알코올단독 투여군에서 부분적인 출혈과 비후된 모습과 지방으로 축적으로 인해서 겉 표면이 황색을 나타내며 알코올-fistin투여군에서는 정상군과 유사한 모습을 보인다고 보고 하였으나 본연구와는 실험기간의 차이가 있어 AL군이나 AL-LC군 모두 외견상 황색의 변화는 보이지 않아 차이가 있었다.
본 연구에서는 AL군에서 중심정맥을 중심으로 세포내 지방 방울이 형성되었고 세포 침윤현상과 괴사가 관찰되었으며, 중심정맥의 내막층이 분리되거나 절단되고 위축되는 불규칙적인 모양을 보였다. 알콜성 간 중독과 유사한 특징을 보이는 사염화탄소를 이용한 실험[37]에서 사염화 탄소 단독 투여군에서는 중심정맥 주변으로 심한 괴사가 나타나고 괴사 주변 지방변화를 동반한 개별적인 간세포의 퇴화를 나타났으며, Kim등의 알코올 간 손상 실험[3]에서 알콜 섭취군에서는 간조직 내에 과도한 지방축적으로 지방방울형성이 과도하게 일어나 세포안을 차지하고 있다고 하였고, 죽력량 변화에 따른 간 손상 실험[38]에서 증가된 고농도의 간 조직은 간세포의 팽창 과 중심정맥의 내피가 분리, 절단된 모습과 중심정맥의 위축이 관찰되어 전형적인 간손상의 모습을 보여 본 실험과 유사하였다. 또한 AL- LC 200군에서는 AL군에 비하여 지방 방울 축적 증상이 감소하였고 AL- LC 400군에서는 Con군과 유사한 모습을 보였다. Kim등의 [3]실험에서 알코올 군에 비하여 알코올-후코이단 투여군에서도 지방방울의 감소현상이 관찰되었고, Kim 등[37]의 사염화탄소-생식 투여군에서도 개별적인 간세포의 퇴화가 일부에서만 나타나 사염화 탄소 단독 투여군에 비하여간세포 손상이 완화되었다고 보고하였고 Kim 의[38]실험에서 저농도의 죽력량군에서는 간세포들의 팽창, 혈구들의 응집이 관찰되어 고농도 죽력량군에 비해 간 손상이 완화되어 본 연구 실험 결과들과 유사하였다.
AST, ALT활성도와 간 조직학적 결과를 비교하면 AL군에 비하여 AL-LC 200, 400군에서 간손상이 완화되었다.
따라서 야관문 추출물은 flavonoid, phenol성분과 같은 생리활성 물질을 많이 함유 하고 있어 알코올과 같은 외부자극에 간세포의 안정화에 기여함으로써 체내 과산화 작용에 의한 염증의 유발 및 이에 따른 면역체계의 활성화 조절하여 간세포손상을 억제하는 물질로서 알코올 중독현상 완화에 관한 임상에서의 유용성이 기대된다고 본다.
References
[1] H. Y. Yu, C. M. Kim, K. H. Koo, “An experimental study on the effect of ginseng saponin upon alcoholic liver injury”, J. Hanyang Med. Coll. 2(2), pp. 287-304, 1982.
[2] Segye Times 3. 17. 2016.
[3] M. J. Kim, J. Jeon, S. P. Lee, J. S. Lee, “Protective Effects of Fucoidan against Acute Alcohol-induced Liver Injury in Rats” kor. J. Food Sci. Technol. 46(2), pp. 219-223, 2014.
DOI: http://dx.doi.org/10.9721/KJFST.2014.46.2.219
[4] A. Szilagyi, “Liver diseases in the alcoholic.” Can. Fam. Physician. 32, pp. 1938-1941, 1986.
[5] E. H. Lee, J. H. Chyun, “Effects of beta-carotene supplementation on lipid peroxide levels and antioxidative enzyme activities in alcoholic fatty liver rats” Korean J. Nutr. 38, pp. 289-296, 2005.
[6] D. H. Kim, H. K. Kim “A study on pruritus of female alcoholics” J. Kor. Aca. Indus. coope. Soc. 14(9), pp. 4412-4420, 2013.
[7] Y. T. Chung, K. A. Chung, S. S. Chang, “Human Physiology” Cheong Gu moonhwasa, Seoul. pp. 184-186 2009.
[8] D. H. Youn, W. I. Kim, C. S. Na, "Effects of combination pear extract with Daekumeumjagami medication on hepatic injury induced by alcohol in mice" Kor. J. Herbology 30(1), pp. 51-57, 2015.
DOI: http://dx.doi.org/10.6116/kjh.2015.30.1.51.
[9] W. S. Choi, D. Y. Jang, K. M. Cha, C. K. Park “Enhanced Activities of Alcohol Methabolism by Extracts from Hericium erinaceum Hypha Cultivated with Artermisia capillaris(HEAC) ” j . Kor. Aca. Indus. coope. Soc. 9(1), pp. 189-194, 2013.
[10] H. K. An, J. Y. Park, H. J. Yoon “Association of among alcohol consumption and blood vitamin D and lead concentrations: Basedon 2010-2012 Korea national health and nutrition examination survey” JKAIS, 16(1) pp. 498-506, 2015.
DOI: http://dx.doi.org/10.5762/KAIS.2015.16.1.498
[11] S. K. Park, Y. C. Cho, “Relationships Between Alcohol Intake and Blood Pressure, Serum Lipids, Liver Function Tests and ObesityIndices in Middle-Aged Male Workers” JKAIS, 16,(5), pp. 3323-3332, 2015.
DOI: http://dx.doi.org/10.5762/KAIS.2015.16.5.3323
[12] G. H. Choi, J. G. Kim, S. T. Kwon, "Protective Effects of Food Including Hovenia dulcis on Acute Alcohol Intoxication" J Korean Soc Food Sci Nutr 40(8), pp. 1107-1112, 2011.
DOI: http://dx.doi.org/10.3746/jkfn.2011.40.8.1107
[13] S. H. Lee, Y. S. Song, S. Y. Lee, S. Y. Kim, K. S. Ko “Protective Effects of Akebia quinata Fruit Extract on Acute Alcohol-induced Hepatotoxicity in Mice” J. Food Sci. Techol. 46(5), pp. 622-629, 2014.
DOI: http://dx.doi.org/10.9721/kjfst.2014.46.5.622
[14] G. H. Choi, J. G. Kim, S. T. Kwon “Protective Effects of Food Including Hovenia dulcis on Acute Alcohol Intoxication” J Kor. Soc Food Sci. Nutr 40(8), pp. 1107-1112, 2011.
DOI: http://dx.doi.org/10.3746/jkfn.2011.40.8.1107
[15] B. S. Cho, J. J. Lee, M. Y. Lee “Effects of Ethanol Extracts from Petasites japonicus S. et Z. Max. on Hepatic Antioxidative Systems in Alcohol Treated Rats” J Korean Soc Food Sci. Nutr. 36(3), pp. 298-304, 2007.
DOI: http://dx.doi.org/10.3746/jkfn.2007.36.3.298
[16] Y. J. Choi, K. I. Jung “Anti-Diabetic, Alcohol-Metabolizing, and Hepatoprotective Activities of Moringa (Moringa oleifera Lam.) Leaf Extracts” J Kor. Soc Food Sci. Nutr. 45(6), pp. 819-827, 2016.
[17] C. K. Han, K. S. Seong, K.W. Lee, S. S. Park, J. Y. Jeong, S. S. Kim “Effects of Omija (Schizandra chinensis Baillon) Concentrate on BloodAlcohol Clearance and Hepatoprotective Function in Rats Induced by Acute Ethanol Intoxication and Chronic Ethanol Treatment” J. Kor. Soc. Food Sci. Nutr. 43(8), pp. 1139-1147, 2014.
DOI: http://dx.doi.org/10.3746/jkfn.2014.43.8.1139
[18] E. K. Cho, Kyung Im Jung, Young Ju Choi Anti-Diabetic, Alcohol Metabolizing Enzyme, and Hepatoprotective Activity of Acer tegmentosum Maxim. Stem Extract” J. Kor. Soc. Food Sci. Nutr. 44(12), pp. 1785-1792, 2015.
DOI: http://dx.doi.org/10.3746/jkfn.2015.44.12.1785
[19] H. J. Kim, K. S. Kim, D. I. Kim, "Inhibitory effects of Lespedeza cuneata ethanol extract on ultraviolet-induced photo aging" J Korean Soc Food Sci Nutr 41, pp. 1540-1545, 2012.
DOI: http://dx.doi.org/10.3746/jkfn.2012.41.11.1540
[20] H. M. Park, J. H. Hong, "Physiological activities of Lespedeza cuneata extracts" Korean J. Food Preserv. 21(6), pp. 844-850, 2014.
DOI: http://dx.doi.org/10.11002/kjfp.2014.21.6.844
[21] A. Numata, K. Hokimoto, H. Yamaguchi, "C-Glycosylflavones in Lespedeza cuneata", Chem. Pharm. Bull., 28, pp. 964-965, 1980.
DOI: http://dx.doi.org/10.1248/cpb.28.964
[22] S. Matsuura, M. Iinuma, E. Ito, H. Takami, K. Kagei, "Studies on the constituents of the useful plants. VIII. The constituents of Lespedeza cuneata G. Don." Yakugaku Zasshi 98, pp. 1542-1544, 1978.
[23] H. J. Lee, G. N. Lim, M. A. Park, S. N. Park, "Antibacterial and antioxidative activity of Lespedeza cuneata G. Don." Kor. J. Microbiol Biotechnol 39, pp. 63-69, 2011.
[24] H. K. Jung, K. S. Kim, Y. S. Jeong, "Wound Healing Effects of Lespedeza cuneata Extract" J. Kor. Soc. Food Sci. Nutr, 43(3), pp. 374-380, 2014.
DOI: http://dx.doi.org/10.3746/jkfn.2014.43.3.374
[25] H. I. Lee, J Y. Jung, M. B. Hwang, S. K. Ku, Y. W. Kim, S. Y. Jee, “Anti-inflammatory effects of Lespedeza Cuneata in vivo and in vitro”, Kor J Herbology, 28(4), pp. 83-92, 2013.
DOI: http://dx.doi.org/10.6116/kjh.2013.28.4.83
[26] E. J. Cho, H. M. Ju, C. H. Jeong, S. H. Eom, H. J. Heo, D. O. Kim, "Effect of Phenolic Extract of Dry Leaves of Lespedeza cuneata G. Don on Antioxidant Capacity and Tyrosinase Inhibition", Kor. J. Hort. Sci. Technol. 29(4), pp. 358-365, 2011.
[27] K. A. Chung, M. J. Cheong “Effects of Lespedeza Caneata ethanol extract on the Liver, Kidneys of Lead administered Mice” JKAIS, vol. 17, no. 6, pp. 207-214, 2016.
DOI: http://dx.doi.org/10.5762/KAIS.2016.17.6.207
[28] D. I. Kim, J. H. Hong, “Optimization of Ethanol Extraction Conditions for Functional Components from Lespedeza cuneata Using Response Surface Methodology”, Kor. J. Food Cookery .Sci., 28(3), pp. 275-283, 2012.
DOI: http://dx.doi.org/10.9724/kfcs.2012.28.3.275
[29] J. G Lee, E. H. Kim, J. H. Lee, "Effect of Gentianae Radix on Neurogenesis and Apoptosis in Hippocampus of ethanol-induced Newborn Rats" J. Oriental Neuro. 21(2), pp. 29-44, 2010.
[30] Min S. K. Modern psychiatry 5th ilchokak seoul pp. 32, 39-40, pp. 44-50, 2011.
[31] J. Tuma, C. A.Casey, "Dangerous byproducts of alcohol breakdown focus on adducts" Alcohol Res Health. 27(4), pp. 285-290, 2013.
[32] S. Y. Joo “Preventive medicine” Gaechuk moonhwasa, Seoul. pp. 288-294 1995.
[33] Y. S. Kim, J. Y. Park, Y. B. Kwon, D. W. Lim, M. K. Song , H. Y. Choi, H. C. Kim, "Hepatoprotective Effects of Hovenia dulcis Extract on Acute and Chronic Liver Injuries induced by Alcohol and Carbon Tetrachloride" J. Herb. 28(4), pp. 25-32, 2013.
DOI: http://dx.doi.org/10.6116/kjh.2013.28.4.25
[34] J. H. Lefkowitch "Morphology of alcoholic liver disease" Clin. Liver Dis. 9, pp. 37-53, 2005.
DOI: http://dx.doi.org/10.1016/j.cld.2004.11.001
[35] J. M. Crawford, "Histologic findings in alcoholic liver disease" Clin. Liver Dis. 16, pp. 699-716, 2012.
DOI: http://dx.doi.org/10.1016/j.cld.2012.08.004
[36] M. Koneru, B. D. Sahu, J. M. Kumar, M. Kuncha, A. Kadari, E. K. Kilari, R. Sistla, "Fistin protects liver from binge alcohol–induced roxicity by mechanisms incuding inhibition of matrix metalloproteins and oxidative stress" J. funct. food 22, pp. 588-601, 2016.
[37] D. H. Kim, Y. K. Deung, Y. M. Lee, Y. S. Yoon, K. J. Lee, "The effect of saengshik od the hepatotoxicity of mouse induced by carbon tetrachloride" Kor. J. Elec. Microscop, 37(1), pp. 11-21, 2007.
[38] J. S. Kim, "the antioxidant enzymes and histopathological changes of liver and kidney according to administered dosage of Bambusae caulis in liquamen in mice" Kor. J. Elec. Microscop. 32(4), pp. 399-410, 2002.
|
정 민 주(Min-Ju Cheong) [정회원] |
|
|
|
•1995년 2월 : 호남대학교 생물학과 (이학사) •1998년 8월 : 조선대학교 대학원 생물학과 (이학석사) •2004년 2월 : 조선대학교 대학원 생물학과 (이학박사) •2001년 3월 ~ 현재 : 조선대학교 생명과학과 시간강사 |
|
<관심분야> 해부학, 생리학 |
|
|
정 경 아(Kyoung-A Chung) [정회원] |
|
|
|
•1991년 2월 : 조선대학교 사범대학 생물교육학과 (이학사) •1993년 8월 : 조선대학교 대학원 생물학과 (이학석사) •1998년 8월 : 조선대학교 대학원 생물학과 (이학박사) •2014년 3월 ~ 현재 : 동신대학교 작업치료학과교수 |
|
<관심분야> 해부학, 생리학 |
|